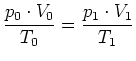



Next: Volumengesetz
Up: Volumenverhältnis bei chemischen Reaktionen
Previous: Volumenverhältnis bei chemischen Reaktionen
Contents
Index
-
- Kolbenprober
- B:
- Temperaturveränderung:
- Erwärmung:
 Volumenausdehnung (
Volumenausdehnung (
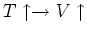 )
)
- Abkühlung:
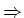 Volumenverkleinerung (
Volumenverkleinerung (
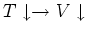 )
)
- Druckänderung:
- Erhöhung:
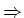 Volumenverminderung (
Volumenverminderung (
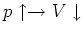 )
)
- Erniedrigung:
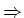 Volumenvergrößerung (
Volumenvergrößerung (
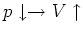 )
)
Alle Gase verhalten sich gleich.
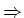 Ideale Gasgesetz:
Ideale Gasgesetz:




Next: Volumengesetz
Up: Volumenverhältnis bei chemischen Reaktionen
Previous: Volumenverhältnis bei chemischen Reaktionen
Contents
Index
2003-03-30
 Volumenausdehnung (
Volumenausdehnung (
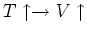 )
)
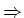 Volumenverkleinerung (
Volumenverkleinerung (
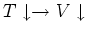 )
)
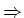 Volumenverminderung (
Volumenverminderung (
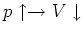 )
)
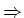 Volumenvergrößerung (
Volumenvergrößerung (
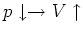 )
)