Bis 1962 gailt die Einheit:
![]() .
Seit 1962 gilt: Bezugspunkt für alle relative Atommassen ist das
Kohlenstoffatom
.
Seit 1962 gilt: Bezugspunkt für alle relative Atommassen ist das
Kohlenstoffatom ![]() C. Seine relative Masse beträgt
C. Seine relative Masse beträgt ![]() .
.
![]() der Masse des C-Atoms ist die atomare Masseneinheit
der Masse des C-Atoms ist die atomare Masseneinheit ![]() .
.
Die relative Molekülmasse ![]() ist die Summe der relativen Atommassen der zu
diesem Molekül vereinigten Atome.
ist die Summe der relativen Atommassen der zu
diesem Molekül vereinigten Atome.
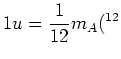 C
C
Allgemein: A![]() B
B![]() C
C![]()
![]()
![]() A
A![]() B
B![]() C
C![]()