0.1 ↑ Protolyse-Gleichgewichte
0.1.1 ↑ Protolysereaktionen
- Protonen-Donatoren
Teilchen, die bei einer Reaktion Protonen abgeben
- Protonen-Akzeptoren
Teilchen, die bei einer Reaktion Protonen aufnehmen
- Protolyse-Übergang
H_3PO_4 + OH^- \leftrightharpoons H_2PO_4^- + H_2O
Eine Säure und die aus ihr durch Abgabe eines Protons hervorgegangene Base bilden ein korrespondierendes Säure/Base-Paar.
\text{S"aure} {\renewcommand{\arraystretch}{0.5}\begin{array}{c}\text{\tiny{}Protonen-Abgabe}\\\leftrightharpoons\\\text{\tiny{}Protonen-Aufnahme}\end{array}\renewcommand{\arraystretch}{1.0}} \text{Korrespondierende Base}
- Ampholyte
Teilchen, die je nach Reaktionspartner als Säure oder Base reagieren
Beispiel: H_3O^+ \longleftarrow H_2O \longrightarrow OH^-
- Protonen-Donatoren
Neutralsäuren: HCl, H_2SO_3, H_2SO_4, H_2CO_3, H_2O, H_3PO_4
Kationsäuren: NH_4^+, H_3O^+
Anionsäuren: H_3PO_4^-, HSO_4^-, HSO_3^-, HCO_3^-
- Protonen-Akzeptoren
Neutralbasen: NH_3, H_2O
Anionbasen: OH^-, SO_4^{2-}, HSO_4^-, PO_4^{3-}
0.1.2 ↑ Autoprotolyse des Wassers
H_2o + H_2O \leftrightharpoons H_3O^+ + OH^-
0.1.2.1 ↑ Massenwirkungsgesetz
K_c = \frac{c(H_3O^+)c(OH^-)}{c^2(H_2O)}
c(H_3O^+) = c(OH^-) = 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
V = 1\mathrm{l}
\varrho = 0,\!998\frac{\mathrm{kg}}{\mathrm{l}}
T = 25^\circ{}\mathrm{C}
M = 18\frac{\mathrm{g}}{\mathrm{mol}}
m = 0,\!998\frac{\mathrm{kg}}{\mathrm{l}} \cdot 1\mathrm{l} = 998\mathrm{g}
n = \dfrac{998\mathrm{g}}{18\frac{\mathrm{g}}{\mathrm{mol}}} = 55,\!5\mathrm{mol}
c(H_2O) = 55,\!5\frac{\mathrm{mol}}{\mathrm{l}}
K_c = \ldots = 3,\!2 \cdot 10^{-18}
0.1.2.2 ↑ Ionenprodukt des Wassers
MWG: K_c = \frac{c(H_3O^+)c(OH^-)}{c^2(H_2O)}
K_c \cdot c^2(H_2O) = c(H_3O^+)c(OH^-)
K_w = c(H_3O^+)c(OH^-) = 10^{-14}\left(\frac{\mathrm{mol}}{\mathrm{l}}\right)^2 bei T = 25^\circ\mathrm{C}
Das Ionenprodukt K_w des Wassers ist die Konstante aus dem Produkt der Konzentration der Oxonium-Ionen (H_3O^+) und der Hydroxid-Ionen (OH^-). Sie gilt nur in verdünnten wässrigen Lösungen und ist von der Temperatur abhängig.
- In neutralen Lösungen
c(H_3O^+) = c(OH^-) ⇒ K_w = c^2(H_3O^+) = 10^{-14}\left(\frac{\mathrm{mol}}{\mathrm{l}}\right)^2
c(H_3O^+) = 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
- In sauren Lösungen
c(H_3O^+) > 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
c(OH^-) < 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
- In alkalischen Lösungen
c(H_3O^+) < 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
c(OH^-) > 10^{-7}\frac{\mathrm{mol}}{\mathrm{l}}
0.1.3 ↑ Der pH-Wert
0.1.3.1 ↑ Definition
pH = -\lg c(H_3O^+)
c(H_3O^+) = 10^{-pH}\frac{\mathrm{mol}}{\mathrm{l}}
Entsprechend: pOH = -\lg c(OH^-)
c(OH^-) = 10^{-pOH}\frac{\mathrm{mol}}{\mathrm{l}}
pH + pOH = 14 bei T = 25^\circ\mathrm{C}
0.2 ↑ pH- und pOH-Wert starker Säuren und Basen
HCl, HNO_3, H_2SO_4, H_3PO_4, HClO_4
HA + H_2O \leftrightharpoons H_3O^+ + A^-
Bei einer starken Säure liegt das Gleichgewicht weit auf der Seite der Produkte.
0.2.1 ↑ Säure- und Basenkonstante
0.2.1.1 ↑ Säurekonstante
HA + H_2O \leftrightharpoons H_3O^+ + A^-
MWG: \frac{c(H_3O^+)c(A^-)}{c(HA)c(H_2O)} = K_c
K_c \cdot c(H_2O) = \frac{c(H_3O^+)c(A^-)}{c(HA)} = K_s (Säurekonstante)
⇒ pK_s = -\lg K_s
Je größer K_s, desto stärker ist die Säure. Je größer pK_s, desto schwächer ist die Säure.
0.2.1.2 ↑ Basenkonstante
A^- + H_2O \leftrightharpoons HA + OK^-
MWG: K_c = \frac{c(HA)c(OH^-)}{c(A^-)c(H_2O)}
K_c \cdot c(H_2O) = K_b = \frac{c(HA)c(OH^-)}{c(A^-)} (Basenkonstante)
⇒ pK_b = -\lg K_b
Je größer K_b, desto stärker ist die Base. Je größer pK_b, desto schwächer ist die Base.
0.2.1.3 ↑ Für ein korrespondierendes Säure/Base-Paar gilt
K_s \cdot K_b = \frac{c(H_3O^+)c(A^-)}{c(HA)} \cdot \frac{c(HA)c(OH^-)}{c(A^-)} = c(H_3O^+)c(OH^-) = K_w = 10^{-14} \frac{\mathrm{mol}^2}{\mathrm{l}^2}
⇒ pK_s + pK_b = pK_w = 14
0.2.1.4 ↑ Vorhersagen für Protolysereaktionen
0.2.1.5 ↑ Berechnung des pH-Werts von Säuren und Basen
- a) Berechnung des pH-Werts einer "starken" Säure (pKs < 3,5)
Bei starken Säuren (analoges gilt für Basen) verlaufen die Protolysen praktisch vollständig.
c_{Gl}(H_3O^+) = c_0(HCl)
pH = -\lg c_0(HCl) = -\lg c_{Gl}(H_3O^+)
- b) Berechnung des pH-Werts einer schwachen Säure (pKs > 3,5)
Die Protolyse verläuft nicht vollständig.
HA + H_2O \leftrightharpoons H_3O^+ + A^-
K_s = \frac{c_{Gl}(A^-)c_{Gl}(H_3O^+)}{c_{Gl}(HA)}
c_{Gl}(A^-) = c_{Gl}(H_3O^+)
c_{Gl}(HA) \approx c_0(HA)
K_s = \frac{c_{Gl}^2(H_3O^+)}{c_0(HA)}
c_{Gl}(H_3O^+) = \sqrt{K_s \cdot c_0(HA)}
c_{Gl}(H_3O^+) = \left[K_s \cdot c_0(HA)\right]^{\frac{1}{2}}
pH = \frac{1}{2}\left[pK_s - \lg c_0(HA)\right]
Analog gilt für schwache Basen:
pOH = \frac{1}{2}\left[pK_b - \lg c_0(A^-)\right]
Beispiele zur Berechnung:
Ammoniak: c_0(NH_3) = 0,\!5\frac{\mathrm{mol}}{\mathrm{l}}
Essigsäure: c_0(HAc) = 0,\!1\frac{\mathrm{mol}}{\mathrm{l}}
Salzsäure: c_0(HCl) = 0,\!1\frac{\mathrm{mol}}{\mathrm{l}}
0.2.1.6 ↑ Säure/Base-Indikatoren
Versuch: Blaukrautsaft zeigt in Abhängigkeit des pH-Werts unterschiedliche Farben.
Versuch: Testen verschiedener Indikatoren
- a) Wirkungsweise eines Indikators
HInd + H_2O \leftrightharpoons H_3O^+ + Ind^-
Säure/Base-Indikatoren sind Farbstoffe, die als schwache Säure oder Base fungieren. Die Indikator-Säure (HInd) und die korrespondierende Indikator-Base (Ind^-) unterscheiden sich in ihrer Phase. Der Farbumschlag wird durch eine Protolysereaktion verursacht.
0.2.1.7 ↑ Protolysereaktionen
Salze starker Basen und starker Säuren reagieren in wässriger Lösgung neutral. Salze schwacher Basen und starker Säuren reagieren in wässriger Lösung sauer. Salze starker Basen und schwacher Säuren reagieren in wässriger Lösung basisch.
0.2.1.8 ↑ Puffersysteme
- a) Definition
Puffersysteme sind Lösungen schwacher Säuren (Basen) und ihrer korrespondierenden Basen (Säuren). Sie ändern ihren pH-Wert bei Zugame von H_3O^+-Ionen (OH^--Ionen) nur wenig.
HA + H_2O \leftrightarrow H_3O^+ + A^-
- b) Anwendung des Massenwirkungsgesetzes
K_s = \frac{c(H_3O^+)c(A^-)}{c(HA)} ⇒ c(H_3O^+) = K_s \frac{c(HA)}{c(A^-)}
pH = pK_s - \lg \frac{c(HA)}{c(A^-)} (Henderson-Hasselbalch-Gleichung)
Für ein äquimolares Gemisch gilt: pH = pK_s
- c) Biologische Bedeutung
Puffermischung des Bodens, Pufferung im Blut
- Versuch
Titration einer schwachen Säure
- Skizze
c(OH^-) = 1 \frac{\mathrm{mol}}{\mathrm{l}} (Natronlauge)
c_0(HAc) = 0,\!1 \frac{\mathrm{mol}}{\mathrm{l}} (Essigsäure)
- Berechnung des Start-pHs
pH = \frac{1}{2}\left[pK_s - \lg c_0(HAc)\right] = 2,\!87
- Messwerttabelle/Graph
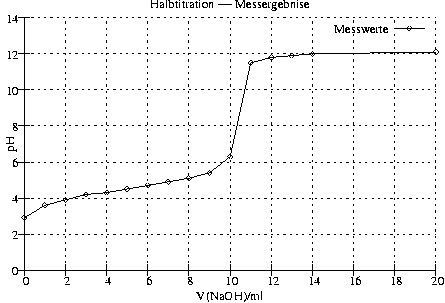
[Halbäquivalenzpunkt bei V(NaOH) = 5\mathrm{ml}, Äquivalenzpunkt bei V(NaOH) = 10\mathrm{ml}
Bei V(NaOH) = 0: n(HAc) = 0,\!01\mathrm{mol}
Beim Halbäquivalenzpunkt: n(HAc) = 0,\!005\mathrm{mol}, n(Ac^-) = 0,\!005\mathrm{mol}
Beim Äquivalenzpunkt: n(HA) = 0\mathrm{mol}, n(Ac^-) = 0,\!01\mathrm{mol}]
HAc + OH^- \leftrightharpoons H_2O + Ac^-
pH am Halbäquivalenzpunkt:
n(HAc) = n(Ac^-) ⇒ c(HAc) = c(Ac^-) ⇒ pH = pK_s = 4,\!74
pH am Äquivalenzpunkt:
n(Ac^-) = 0,\!01\mathrm{mol}
pK_b(Ac^-) = 9,\!26
V = 0,\!11\mathrm{l}
pH = 14 - pOH
pOH = \frac{1}{2}\left[pK_b - \lg c_0(Ac^-)\right]
c_0(Ac^-) = \frac{n(Ac^-)}{V}
pH = 14 - \frac{1}{2}\left[pK_b - \lg \frac{n(Ac^-)}{V}\right] = 8,\!85