0.1 ↑ Geschwindigkeit bei Reaktionen
- Versuch
Salzsäure reagiert mit Magnesium
- Erklärung
2 HCl + Mg \longrightarrow MgCl_2 + H_2
- Beobachtung
Das Mg-Pulver reagiert schneller mit der Salzsäure als die Mg-Späne.
Definition: \text{Reaktionsgeschwindigkeit} = \frac{\text{Stoffumsatz}}{\text{Zeit}};
(Hier: Siehe Abbildung zu 'Geschwindigkeit bei Reaktionen'.png)
0.1.1 ↑ Einflussgrößen auf die Reaktionsgeschwindigkeit
0.1.1.1 ↑ Abhängigkeit vom Zerteilungsgrad
- Versuch
Änderung des Zerteilungsgrades von Magnesium mit Salzsäure
- Beoabachtung
Heftige Gasentwicklung (H_2)
- Ergebnis
Mg + 2HCl \longrightarrow H_2 + MgCl_2
Red.: 2H_3O^+ + 2e^- \longrightarrow H_2 + 2H_2O
Ok.: Mg \longrightarrow Mg^{2+} + 2e^-
⇒ 2H_3O^+ + Mg \longrightarrow Mg^{2+} + H_2 + 2H_2O
Bei feinerer Verteilung wird die Oberfläche des Feststoffes vergrößert. Damit wächst die Zahl und somit die Konzentration der reaktionsbereiten Teilchen an der Oberfläche. Die Reaktionsgeschwindigkeit wird dadurch gesteigert.
0.1.1.2 ↑ Anwendungen im Alltag
Wirbelschichtverfahren
Lunge
Darm
0.1.1.3 ↑ Abhängigkeit von der Temperatur
- Versuch
Zwei Reagenzgläser, beide mit 0,1 molarer Thiosulfatlösung, das eine erhitzt, das andere nicht
- Beobachtung
Trübung
Zunahme der Reaktionsgeschwindigkeit bei steigender Temperatur
Beispiel: NO_2 + CO \longrightarrow NO + CO_2
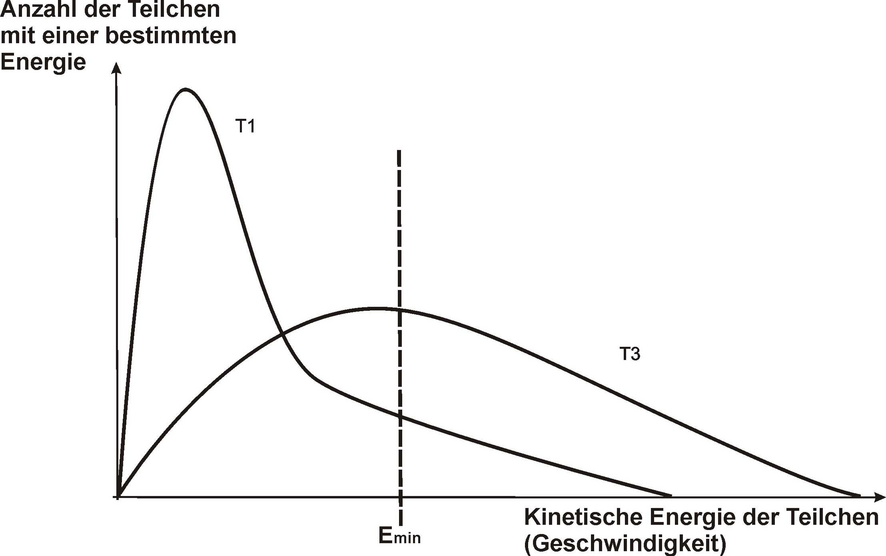
Ein erfolgreicher Zusammenstoß setzt eine Mindestenergie und die richtige Orientierung der Teilchen voraus.
Bei Erhöhung der Temperatur wird die Anzahl der Teilchen, die die Mindestenergie überschreiten, größer. Für den Reaktionserfolg von Teilchen ist der Zusammenstoß von Teilchen mit einer bestimmten, für das jeweilge Stoffsystem typischen, kinetischen Mindestenergie erforderlich.
RGT-Regel: Bei einer Temperaturerhöhung um 10 ^\circ\mathrm{C} verdoppelt bis verdreifacht sich die Reaktionsgeschwindigkeit (in einem Temperaturbereich von 0 ^\circ\mathrm{C} bis 40 ^\circ\mathrm{C}).
0.1.1.4 ↑ Abhängigkeit von der Konzentration
- Versuch
Natriumthiosulfatlösungen (verschiedener Konzentration) mit verdünnter Salzsäure
- Beobachtung
Je höher die Konzentration an Natriumthiosulfatlösung, desto schneller erfolgt die Reaktion (Trübung).
Fazit: t \sim \frac{1}{c};
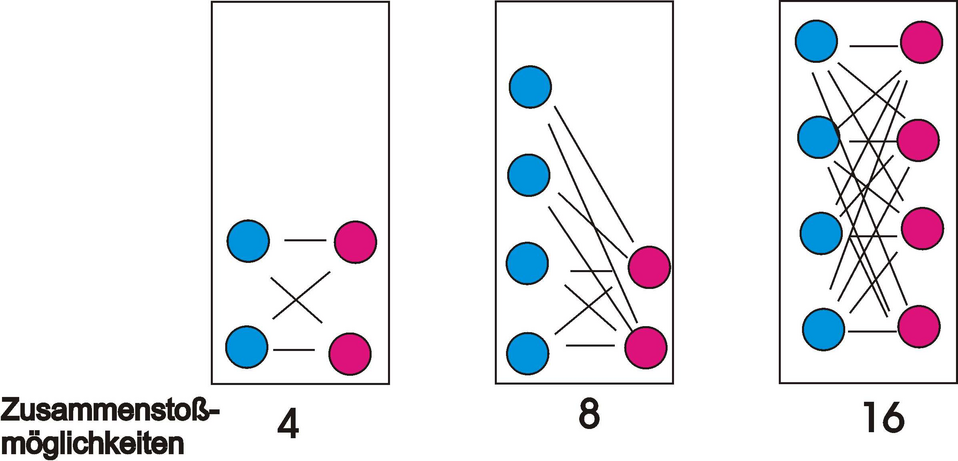
Die Geschwindigkeit einer chemischen Reaktion ist proportional dem Produkt der Konzentration der Ausgangsstoffe. Bei höherer Konzentration ist die Wahrscheinlichkeit, dass sich zwei Teilchen treffen, größer als bei nieder Konzentration (nach der Kollisionstheorie).
{} \begin{array}{rcl|l} {} \left(S_2O_3\right)^{2-} + 2H_3O^+ & \longrightarrow & H_2S_2O_3 + 2H_2O \qquad & \text{schnell} \\ {} H_2S_2O_3 & \longrightarrow & S + SO_2 + H_2O \qquad & \text{langsam} \\ {} 8 S & \longrightarrow & S_8 & \\ {} \text{Gesamtreaktion:} & & & \\ {} \left(S_2O_3\right)^{2-} + 2H_3O^+ & \longrightarrow & S + SO_2 + 3H_2O & {} \end{array}
Die langsamste Teilreaktion ist der geschwindigkeitsbestimmende Schritt.
Massenwirkungsprodukt
Beispiel: H_2 + I_2 \longrightarrow 2HI ⇒ RG = \left(k_1 \cdot k_2 = k\right) \cdot c(H_2) \cdot c(I_2);
Die Geschwindigkeit einer chemischen Rekation ist proportional dem Produkt der Konzentration der Ausgangsstoffe.
0.1.1.5 ↑ Abhängigkeit vom Druck
- Versuch
Einleiten von CO_2 in Wasser mit unterschiedlich hohem Druck
- Beobachtung
Bromthymolblau wechselt Farbe von Blau nach Gelb.
- Auswertung
CO_2 + H_2O \stackrel{\text{Druck}}{\longrightarrow} H_2CO_3 \stackrel{H_2O}{\longrightarrow} H_3O^+ + HCO_3^-
Fazit: Druckerhöhung beschleunigt Reaktionen bei denen mindestens ein gasförmiger Reaktionspartner beteiligt ist.
Fazit: Die Reaktionsgeschwindigkeit ist dem Druck direkt proportional, da eine Druckerhöhung eine Konzentrationserhöhung bewirkt.
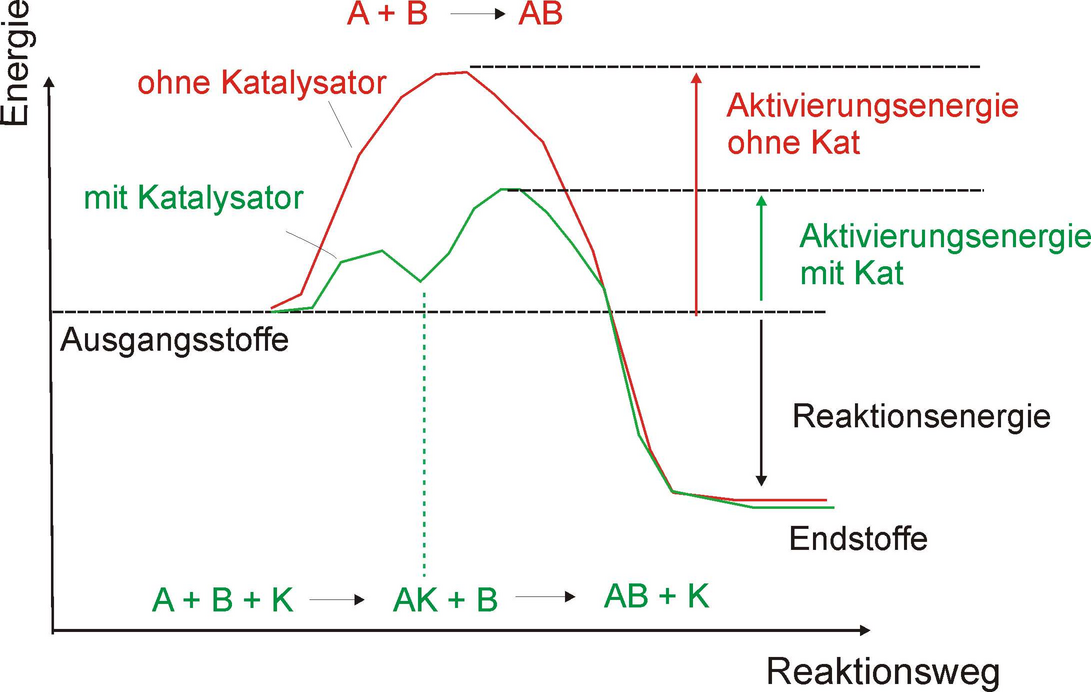
0.1.1.6 ↑ Abhängigkeit vom Katalysator
- Versuch
Katalytische Zersetzung von Wasserstoffperoxid mit Platin
- Beobachtung
Gasentwicklung
- Auswertung
2H_2O_2 \stackrel{Pt}{\longrightarrow} O_2 + 2H_2O
- Versuch
Katalytische Zersetzung von Wasserstoffperoxid mit Braunstein (MnO_2)
- Beobachtung
Glimmspanprobe fällt positiv aus, Gasentwicklung.
- Auswertung
2H_2O_2 \stackrel{MnO_2}{\longrightarrow} O_2 + 2H_2O
Heterogene Katalyse: Katalysator und reagierende Stoffe liegen in verschiedenen Phasen vor (hier: fest/flüssig).
- Versuch
Iodidkatalysierte Wasserstoffperoxidzersetzung
- Beobachtung
Glimmspanprobe positiv
- Auswertung
{} \begin{array}{rcl} {} I^- + H_2O_2 & \longrightarrow & IO^- + H_2O \\ {} IO^- + H_2O_2 & \longrightarrow & I^- + H_2O + O_2 \\ {} \text{Gesamtreaktion:} & & \\ {} 2H_2O_2 & \longrightarrow & 2H_2O + O_2 {} \end{array}
Homogene Katalyse: Der Katalysator gehört der gleichen Phase an wie das Reaktionssystem (hier: flüssig/flüssig).
Fazit: Katalysatoren beschleunigen chemische Reaktionen durch Herabsetzen der Aktivierungsenergie. Sie liegen nach der Reaktion unverändert vor.
Diffusion der Reaktionspartner zur Katalysatoroberfläche
Adsorption der Moleküle auf der Oberfläche
Reaktion auf der Oberfläche:
Da bei den adsorbierten Sauerstoffmolekülen die O-O-Bindung gelöst wird, können nun auftretende Wasserstoffmoleküle mit ihnen in Wechselwirkung treten. Unter Spaltung der H-H-Bindung bilden sie mit den Sauerstoff-Molekülen Wasser-Moleküle.
Desorption der Reaktionsprodukte von der Oberfläche
Diffusion der Reaktionsprodukte von der Katalysatoroberfläche in die angrenzende Phase.