0.0.1 ↑ Alkane
Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip: \text{C}_n \text{H}_{2n + 2}
| Formel | Bezeichnung |
|---|---|
| \text{CH}_4 | Methan |
| \text{C}_2\text{H}_6 | Ethan |
| \text{C}_3\text{H}_8 | Propan1 |
| \text{C}_4\text{H}_{10} | Butan |
| \text{C}_5\text{H}_{12} | Pentan |
| \text{C}_6\text{H}_{14} | Hexan |
| \text{C}_7\text{H}_{16} | Heptan |
| \text{C}_8\text{H}_{18} | Octan |
| \text{C}_9\text{H}_{20} | Nonan |
| \text{C}_{10}\text{H}_{22} | Decan |
Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C-C (sp³/sp³) und C-H (sp³/s)-Bindungen (\sigma-Bindungen)
Beispiele:
- Methan
\setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} & | & \\ {} - & \text{C} & - \\ {} & | & \end{array}
- Ethan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & | & & | & \\ {} - & \text{C} & - & \text{C} & - \\ {} & | & & | & \end{array}
- Propan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & \end{array}
- Butan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & | & & & \\ {} & & - & \text{C} & - & & \\ {} & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & \end{array}
- Pentan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & | & & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & & & & | & & & \\ {} & & & & - & \text{C} & - & & \\ {} & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & | & & & \\ {} & & - & \text{C} & - & & \\ {} & & & | & & & \\ {} & & - & \text{C} & - & & \\ {} & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & | & & & \\ {} & & - & \text{C} & - & & \\ {} & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & \\ {} & & - & \text{C} & - & & \\ {} & & & | & & & \end{array}
- Hexan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} & | & & | & & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & & | & & | & & | & \end{array}
0.0.1.1 ↑ Alkane und ihre Eigenschaften
- Siedepunkte/Schmelzpunkte
In der homologen Reihe der Alkane nehmen mit zunehmender Molekülgröße die Siede-/Schmelzpunkte zu.
Erklärung:
\text{CH}_4:
\setlength{\arraycolsep}{0pt} \begin{array}{cccccl} {} & | & & & & \text{V.d.W.-Wechsel-} \\ {} - & \text{C} & - & & & \text{wirkungen} \\ {} & | & & & & \\ {} & & & | & & \\ {} & & - & \text{C} & - & \\ {} & & & | & & \end{array}
\text{C}_5\text{H}_{12}:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccl} {} & | & & | & & | & & | & & | & & \hspace*{3mm} & \text{Summe der V.d.W.-} \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & & \text{wirkungen wird mit} \\ {} & | & & | & & | & & | & & | & & & \text{steigernder Ketten-} \\ {} & \updownarrow & & \updownarrow & & \updownarrow & & \updownarrow & & \updownarrow & & & \text{l"ange gr"o"ser} \\ {} & | & & | & & | & & | & & | & & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & & \\ {} & | & & | & & | & & | & & | & & & \end{array}
V.d.W.-Wechselwirkungen: Grundlage Dipol-Wechselwirkungen! Durch bewegte Ladung (e^-) enstehen momentane Dipole, die such kurzzeitig anziehen können → schwache Wechselwirkungen
- Viskosität
In der homologen Reihe steigt mit zunehmender Kettenlänge die Viskosität an (→ V.d.W.!).
Bei steigender Temperatur sinkt die Viskosität.
- Löslichkeit
Alkane besitzen eine sehr geringe Löslichkeit in Wasser. Höhere Homologe lösen sich gar nicht in Wasser. Erklärung: Wasser ist polar, Alkane sind unplar → keine Hydrathülle (angelagerte Wassermoleküle) möglich!
Alkane lösen sich nur in unpolaren Lösungsmitteln (da unpolare Moleküle des Lösemittels das Alkan umhüllen können).
Alkane sind somit hydrophob bzw. lipophil.
Ähnliches löst in Ähnlichem!
0.0.1.2 ↑ Alkane und ihre Isomere
Beispiel: Butan
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccc} {} & & & & & & & & & & & & & | & & & & \\ {} & & & & & & & & & & & & - & \text{C} & - & & & \\ {} & | & & | & & | & & | & & & & | & & | & & | & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \hspace*{13mm} & - & \text{C} & - & \text{C} & - & \text{C} & - & \\ {} & | & & | & & | & & | & & & & | & & | & & | & & \end{array}
Es muss zwei verschiedene "Stoffe" von der Verbindung Butan geben, da sie sich in ihren physikalischen Eigenschaften unterscheiden.
Die unterschiedlichen physikalischen Eigenschaften ergeben sich aus der verschiedenen Struktur der Moleküle (je geradkettiger das Molekül, desto mehr V.d.W.-Kräfte, desto höher z.B. Siedepunkte).
Da es sich bei beiden Verbindungen um Moleküle mit der gleichen Summenformel handelt, unterscheidet man sie als Isomere, sie sind isomer (selbe Summenformel, unterschiedliche Strukturformel).
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccccl} {} & & & & & | & & & & & & & & & & & & & & \\ {} & & & & - & \text{C} & - & & & & & & & & & & & & & \\ {} & | & & | & & | & & & \hspace*{5mm}=\hspace*{5mm} & & | & & | & & | & & | & & \hspace*{5mm} & \text{(geht durch Drehung um} \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & & & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & & \sigma\text{-Bindung ineinander} \\ {} & | & & | & & | & & & & & | & & | & & | & & | & & & \text{über → identisches Molekül)} \end{array}
[BTW, bei \sigma-Bindungen gibt's immer Drehungen, weil immer ein bisschen Energie da ist]
Kann eine Struktur nicht durch Drehung, sondern muss durch Lösen/Neuknüpfen einer Bindung gebildet werden, so handelt es sich um ein Isomer.
0.0.1.3 ↑ Nomenklatur der Alkane
Da es von einem Alkan mehrere Arten (Isomere) gibt, wird es nötig, die einzelnen Isomere mit Namen voneinander zu unterscheiden.
Regeln der Namensgebung:
Längste Kohlenstoffkette bestimmen und benennen (→ Namensschluss).
Seitenketten ermitteln und benennen (-yl), alphabetisch.
Anzahl der Seitenketten ermitteln und mit griechischen Zahlwörtern kennzeichnen (voranstellen).
Verknüpfung zwischen Haupt- und Seitenketten ermitteln, "Durchnummerieren" der Hauptkette, sodass sich kleinstmögliche Zahlen für die Verknüpfungsstellen ergeben.
Z.B.: 4,5-Diethyl-3,7-dimethyl-7-propylundecan:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} & & & & & | & & | & & & & & \\ {} & & & & - & \text{C} & - & \text{C} & - & & & & \\ {} & & & & & | & & | & & & & & \\ {} & & & & & | & & | & & & & & \\ {} & & & & - & \text{C} & - & \text{C} & - & & & & \\ {} & & & & & | & & | & & & & & \\ {} & & & & & | & & | & & | & & & \\ {} & & & & - & \text{C} & - & \text{C} & - & \text{C} & - & & \\ {} & | & & | & & | & & | & & | & & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & & & & & & \\ {} & | & & | & & | & & & & & & & \\ {} & & & & - & \text{C} & - & & & & & & \\ {} & | & & | & & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & | & & | & & | & & | & \\ {} - & \text{C} & & & - & \text{C} & - & & & & & & \\ {} & | & & & & | & & & & & & & \\ {} - & \text{C} & - & & & & & & & & & & \\ {} & | & & & & & & & & & & & \end{array}
Ergänzung der Regeln:
Die Angabe des "Verzweigungsortes" erfolgt vor der Angabe der Verzweigungsart.
Die alphabetische Anordnung wird ohne Berücksichtigung der griechischen Zahlvorsilben vorgenommen.
Die Angabe n- deutet darauf hin, dass es sich um ein unverzweigtes Alkan handelt.
0.0.1.4 ↑ Alkane und ihre chemischen Eigenschaften
- Brennbarkeit
Je weniger C-Atome, desto leichter brennbar.
Bei längeren C-Ketten muss eine zusätzliche Zufuhr von Sauerstoff gewährleistet sein, um den Stoff zu verbrennen!
\text{C}_4\text{H}_{10} + 6{,}5\,\text{O}_2 \longrightarrow 4\,\text{CO}_2 + 5\,\text{H}_2\text{O}
\text{C}_{10}\text{H}_{22} + 16{,}5\,\text{O}_2 \longrightarrow 5\,\text{CO}_2 + 11\,\text{H}_2\text{O} + 5\,\text{C}
[Die Menge des entstehenden elementaren Kohlenstoffs wurde von uns gewählt; man kann sie nicht aus der Gleichung ablesen]
Wenn höhere Alkane ohne ausreichende Sauerstoffzufuhr verbrannt werden, entsteht dabei elementarer Kohlenstoff (Ruß, gelbe Flamme).
0.0.1.5 ↑ Reaktionen der Alkane mit Halogenen
Alkane zeigen eine Reaktion mit Halogenen.
Z.B.: Methan mit Chlor wird u.a. zu z.B. Chlor-Methan (\text{CH}_3\text{Cl})
→ Substitutionsreaktion: Das H-Atom wird durch ein Halogen-Atom ersetzt!
Reaktionsmechanismus:
\text{Cl}_2 \stackrel{\text{Licht}}{\longrightarrow} 2 \,\text{Cl}\cdot (homolytische Trennung; das \text{Cl}\cdot ist ein Radikal, es stößt wietere Reaktion an, es sucht Edelgaszustand)
\text{Cl}\!\cdot +\, \text{CH}_4 \longrightarrow \text{HCl} + \cdot\text{CH}_3 [das \text{Cl}\cdot-Radikal reißt ein \text{H}\cdot des \text{CH}_4 'raus]
\text{Cl}\!\cdot +\, \cdot\!\text{CH}_3 \longrightarrow \text{CH}_3\text{Cl}
Weitere Möglichkeiten für den Reaktionsmechanismus:
Startreaktion (bildet Radikale):
\text{Cl}_2 \stackrel{\text{Licht}}{\longrightarrow} 2\, \text{Cl}\cdot
Kettenreaktion (Radikale als Edukte und Produkte):
\text{Cl}\!\cdot +\, \text{CH}_4 \longrightarrow \text{CH}_3\!\cdot +\, \text{HCl}
\text{CH}_3\!\cdot +\, \cdot\!\text{Cl} \longrightarrow \text{CH}_3\text{Cl}
- a)
\text{CH}_3\!\cdot +\, \text{Cl}_2 \longrightarrow \text{CH}_3\text{Cl} + \text{Cl}\cdot
- b)
\text{CH}_3\!\cdot +\, \text{CH}_4 \longrightarrow \text{CH}_4 + \text{CH}_3\cdot
Stoppreaktion (vernichtet Radikale durch gegenseitiges Abreagieren):
\text{CH}_3\!\cdot +\, \cdot\!\text{CH}_3 \longrightarrow \text{C}_2\text{H}_6
\text{Cl}\!\cdot +\, \cdot\!\text{Cl} \longrightarrow \text{Cl}_2
Alle Produkte dieser radikalischen Substitution basieren auf zufälligen Bildungen. Es hängt vom Reaktionspartner ab, auf den das Radikal zufällig trifft (→ Statistik!).
\text{C}_2\text{H}_4\text{Cl}_2 aus \text{CH}_4 und \text{Cl}_2?
\text{Cl}\!\cdot +\, \text{CH}_4 \longrightarrow \text{CH}_3\!\cdot +\, \text{HCl}
\text{CH}_3\!\cdot +\, \text{CH}_3\cdot \longrightarrow \text{C}_2\text{H}_6 [unwahrscheinlich]
\text{C}_2\text{H}_6 + \text{Cl}\cdot \longrightarrow \text{C}_2\text{H}_5\!\cdot +\, \text{HCl} [unwahrscheinlich]
[→ Also ist es möglich, aber dauert sehr lange]
\text{C}_2\text{H}_4\text{Cl}_2: 1,1-Dichlorethan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & | & & | & & \\ {} \text{Cl} & - & \text{C} & - & \text{C} & - & \text{Cl} \\ {} & & | & & | & & \end{array}
1,2-Dichlorethan
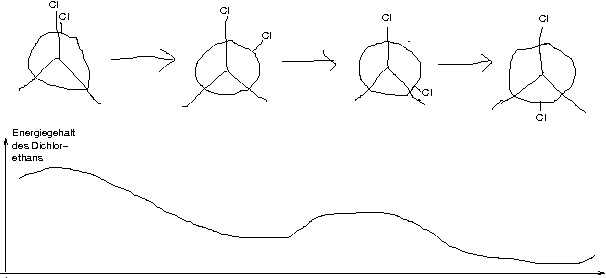
Von Dichlorethan existieren mehrere Isomere. Betrachtet man ein Isomer, so fällt auf, dass es mehrere Konformere davon gibt.
Def.: Konformere sind Moleküöe mit der gleichen Verknüpfung, aber unterschiedlicher räumlicher Anordnung der Atome. Sie entstehen aus einer spontanen Drehung um eine \sigma-Bindung.
Darstellung als Newman-Projektion:
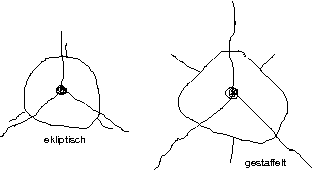
Weiteres Beispiel: \text{C}_2\text{H}_4\text{Cl}_2
0.0.1.6 ↑ Cycloalkane
Allgemeine Formel der Cycloalkane: \text{C}_n\text{H}_{2n} (es fehlen die entständigen H-Atome)
Charakterisierung durch den Besitz von -\text{CH}_2--Gruppen.
→ Unterschiedliches Reaktionsverhalten! Nur wenig stabile Vertreter [\text{C}_5 bis \text{C}_8]
Beispiele:
- Cyclohexan (\text{C}_6\text{H}_{12})
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & \backslash{} & & / & & \\ {} & & & \text{C} & & & \\ {} & | & / & & \backslash{} & | & \\ {} - & \text{C} & & & & \text{C} & - \\ {} & | & & & & | & \\ {} - & \text{C} & & & & \text{C} & - \\ {} & | & \backslash{} & & / & | & \\ {} & & & \text{C} & & & \\ {} & & / & & \backslash{} & & \end{array}

\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccc} {} & | & & | & & | & & \hspace*{7cm} & & | & & | & & | & & | & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \\ {} & | & & | & & | & & & & & \backslash{} & & & & / & & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & & & & - & \text{C} & - & \text{C} & - & & & \\ {} & | & & | & & | & & & & & & | & & | & & & & \end{array}
[XXX: Diese letzten beiden Zeichnungen sind teilweise inkorrekt.]
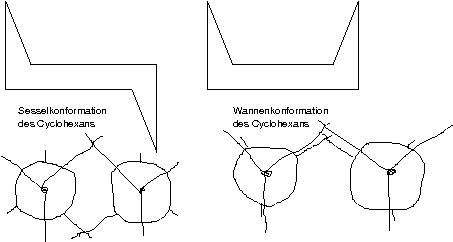
Sesselkonformation: Hier alle Bindungen/Partner auf Lücke
→ weniger Spannung im Molekül \mathrel{\widehat{=}} ist energetisch günstiger
[Das ist auch sichtbar in der "anderen Darstellung" ("räumliche Darstellung"): Der Winkel zu den H-Atomen (nicht eingezeichnet, die Ecken repräsentieren die C-Atome, von denen ausgehend geht's zu den H-Atomen) ist der Tetraederwinkel.]
- Cyclooctan
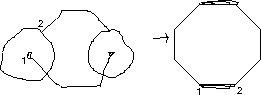
- Cyclopentan
Durch Rotation um \text{C}-\text{C}-Bindungen entsteht [beim Cyclopentan] kein energetisch unterschiedliches Konformeres.
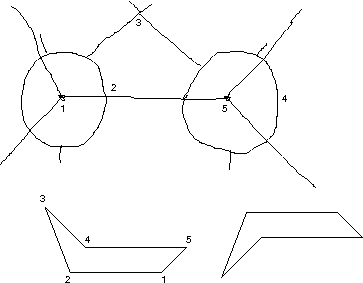
- Butan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} \diagdown & & \diagup & & \diagdown & & \diagup & & \\ {} & \text{C}_{\text{1}} & & & & \text{C}_{\text{3}} & & & \\ {} \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup \\ {} & & & \text{C}_{\text{2}} & & & & \text{C}_{\text{4}} & \\ {} & & \diagup & & \diagdown & & \diagup & & \diagdown \end{array}
Blick auf \text{C}_{\text{1}}-\text{C}_{\text{2}}-Bindung:
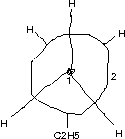
Blick auf \text{C}_{\text{2}}-\text{C}_{\text{3}}-Bindung:
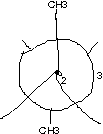
- n-Hexan [Hausaufgabe]
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \\ {} & \text{C}_{\text{1}} & & & & \text{C}_{\text{3}} & & & & \text{C}_{\text{5}} & & & \\ {} \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup \\ {} & & & \text{C}_{\text{2}} & & & & \text{C}_{\text{4}} & & & & \text{C}_{\text{6}} & \\ {} & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown \end{array}
Blick auf \text{C}_{\text{1}}-\text{C}_{\text{2}}-Bindung:
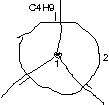
Blick auf \text{C}_{\text{2}}-\text{C}_{\text{3}}-Bindung:
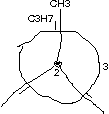
Blick auf \text{C}_{\text{3}}-\text{C}_{\text{4}}-Bindung:
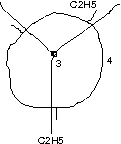
[In Strukturformeln gibt es selbstverständlich keine Angaben zum Konformer, deswegen sind auch alle denkbaren Drehungen in den Newman-Projektionen zulässig.]