0.0.1 ↑ Alkene
Allgemeine Formel der Alkene: \text{C}_n\text{H}_{2n} ← trotz gleicher Formel großer Unterschied zu Cycloalkanen
Einfachstes Alken: \text{C}_2\text{H}_4
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{H} & & & & & & \text{H} \\ {} & \backslash{} & & & & / & \\ {} & & \text{C} & = & \text{C} & & \\ {} & / & & & & \backslash{} & \\ {} \text{H} & & & & & & \text{H} \end{array}
Bindungsverhältnisse bei einer C-C-Doppelbindung
→ sp³-C-Atome sehr schwer zu C=C zu vereinigen → anderer Hybridisierungszustand!
1s² 2sp²-Hybrid³ 2p¹ (C in Doppelbindung sp²-hybridisiert)
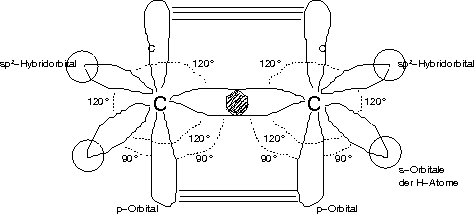
Überlappung von sp²-Hybridorbitalen ist rotationssymmetrisch → \sigma-Bindung
Zwei Überlappungszonen oberhalb/unterhalb der Bindungsebene → \pi-Bindung, nicht rotationssymmetrisch
[Die sp²-Hybridorbitale liegen alle in einer Ebene, die p-Orbitale stehen senkrecht]
0.0.1.1 ↑ Isomere der Alkene
Die homologe Reihe der Alkene enthält den Wortstamm der Alkane, aber mit der Endung -en.
| Formel | Bezeichnung |
|---|---|
| \text{C}_2\text{H}_4 | Ethen |
| \text{C}_3\text{H}_6 | Propen |
| \text{C}_4\text{H}_8 | Buten (ab hier isomere Verbindungen durch die Lage der Doppelbindung) |
| \text{C}_5\text{H}_{10} | Penten |
- 1-Buten
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} | & & | & & | & & | & \\ {} \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & - \\ {} | & & & & | & & | & \end{array}
- 2-Buten/But(2)en
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & = & \text{C} & - & \text{C} & - \\ {} & | & & & & & & | & \end{array}
- Propen
\setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} | & & | & & | & \\ {} \text{C} & = & \text{C} & - & \text{C} & - \\ {} | & & & & | & \end{array}
- 1-Penten
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccc} {} | & & | & & | & & | & & | & \\ {} \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - \\ {} | & & & & | & & | & & | & \end{array}
- Cis-2-Penten
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & | & & | & & | & & | & & | & \\ {} - & \text{C} & - & \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & & & & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & \backslash{} & & & & / & & & & \\ {} & & & \text{C} & = & \text{C} & & & & & \\ {} \backslash{} & & / & & & & \backslash{} & & / & & / \\ {} & \text{C} & & & & & & \text{C} & - & \text{C} & \\ {} / & & \backslash{} & & & & / & & / & & \end{array}
- Trans-2-Penten [nicht 100 % sicher korrekt]
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & | & & | & & & & | & & | & \\ {} - & \text{C} & - & \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & - \\ {} & | & & & & | & & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} \backslash{} & & / & & & & & & & & \\ {} & \text{C} & & & & & & & & & \\ {} / & & \backslash{} & & & & / & & & & \\ {} & & & \text{C} & = & \text{C} & & & & & \\ {} & & / & & & & \backslash{} & & / & & / \\ {} & & & & & & & \text{C} & - & \text{C} & \\ {} & & & & & & / & & / & & \end{array}
Zwei unterschiedliche Moleküle, da um C=C-Bindung keine Drehung!
Die Doppelbindung sorgt für eine weitere Form der Isomerie (cis-trans-Isomerie). Es gilt:
- cis
Die beiden "größten" Reste auf der gleichen Seite.
- trans
Die Beiden "größten" Reste auf gegenüberliegender Seite.
0.0.1.2 ↑ Alkene und ihre Eigenschaften
Physikalische Eigenschaften:
- Schmelzpunkt/Siedepunkt
Da nur V.d.W-Kräfte als zwischenmolekulare Wechselwirkung auftreten vergleichbar niedrig wie bei Alkanen, aufgrund der Doppelbindung aber noch niedriger.
[Durch Doppelbindung 120°-Winkel → nicht mehr so schön geradkettig, sondern Bruch: statt \text{\texttt{----}} \text{\texttt{¯\textbackslash{}\_{}\_{}\_{}}}]
- Viskosität
Geringere Viskosität als Alkane [gleicher Grund wie bei Schmelzpunkt/Siedepunkt]
- Löslichkeit
Alkene sind nahezu unpolare Moleküle → lipophil/hydrophob.
Chemische Eigenschaften:
- Brennbarkeit
Brennbar, aber aufgrund höheren C-Anteils im Molekül ist mehr Sauerstoff [pro Molekül] nötig für eine "saubere" (vollständige [also, IIRC, nicht rußende]) Verbrennung (im Vergleich zu Alkanen).
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \backslash{} & & & & / \\ {} & \text{C} & = & \text{C} & \\ {} / & & & & \backslash{} \end{array}
[Reaktion u.a. zu...:]
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & \text{OH} & \\ {} & | & & | & \\ {} - & \text{C} & - & \text{C} & - \\ {} & | & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} & & | & & | & & | & & | & & | & & \\ {} \cdots & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \cdots \\ {} & & | & & | & & | & & | & & | & & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & | & & | & \\ {} - & \text{C} & - & \text{C} & - \\ {} & | & & | & \\ {} & & & \text{Cl} & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & | & & | & \\ {} - & \text{C} & - & \text{C} & - \\ {} & | & & | & \end{array}
Zahlreiche [weitere] Möglichkeiten
Reaktionsprinzip: Addition an Doppelbindung
Alkene zeigen aufgrund der Doppelbindung im Vergleich zu den Alkanen eine erhöhte Reaktionsbereitschaft.
Beispiel: Reaktion mit \text{Br}_2:
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccc} {} & | & & | & & | & & | & & | & & | \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & = & \text{C} \\ {} & | & & | & & | & & | & & & & | \end{array} + \text{Br}_2 \longrightarrow \setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccc} {} & & & & & & & & & \text{Br} & & & & \\ {} & | & & | & & | & & | & & | & & | & & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{Br} \\ {} & | & & | & & | & & | & & | & & | & & \\ {} & & & & & & & & & \vspace*{1ex} & & & & \end{array}
Reaktionsmechanismus:
\setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} \backslash{} & & / \\ {} & \text{C} & \\ {} & \vert\vert{} & \\ {} & \text{C} & \\ {} / & & \backslash{} \end{array} + \,\text{Br}_2 \stackrel{\text{langsam}}{\rightleftharpoons} \underbrace{\left[ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} \backslash{} & & / & & & & & & & & \\ {} & \text{C} & & & & & & \delta^+ & & \delta^- & \\ {} & \vert\vert{} & \cdot & \cdot & \cdot & \cdot & | & \underline{\overline{\text{Br}}} & - & \underline{\overline{\text{Br}}} & | \\ {} & \text{C} & & & & & & & & & \\ {} / & & \backslash{} & & & & & & & & \end{array} \right]}_{ \setlength{\arraycolsep}{0pt} \begin{array}{l} {} \pi\text{-Komplex} \\ {} \text{p-Orbitale mit} e^- \\ {} \text{verursachen eine} \\ {} \text{Partialladung in} \\ {} \text{Br}_2 \\ {} \text{Wechselwirkung} \\ {} \text{zwischen beiden} \\ {} \text{Molekülen} \end{array} } \rightleftharpoons \underbrace{\left[ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \backslash{} & & / & & \\ {} & \text{C} & & & \\ {} & \vert\vert{} & \backslash{} & & \backslash{} \\ {} & \vert\vert{} & & \text{Br}^\oplus & \\ {} & \vert\vert{} & / & & / \\ {} & \text{C} & & & \\ {} / & & \backslash{} & & \end{array} \right]}_{ \setlength{\arraycolsep}{0pt} \begin{array}{l} {} \sigma\text{-Komplex} \\ {} \text{"`Doppel-} \\ {} \text{bindung"'} \\ {} \text{bricht auf} \end{array} } |\underline{\overline{\text{Br}}}|^\ominus \rightleftharpoons \underbrace{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & \diagdown & & \diagup & & \\ {} & & & \text{C} & & & \\ {} & & & | & \diagdown & & \\ {} | & \underline{\overline{\text{Br}}} & - & \text{C} & & \underline{\overline{\text{Br}}} & | \\ {} & & \diagup & & \diagdown & & \end{array} }_{ \setlength{\arraycolsep}{0pt} \begin{array}{l} {} \text{Angriff} \\ {} \text{des Bromid-} \\ {} \text{ions} \\ {} \text{Auflösung des} \\ {} \sigma\text{-Komplexes} \end{array} }
[Es entsteht also immer 1,2-Dibromethan!]
[Rückseitenangriff (wegen des großen Platzbedarfs der Bromidions (hat ja vier Schalen!)]
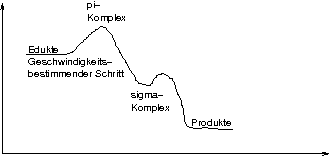
[Dass der \sigma-Komplex leicht energetisch günstiger ist hat man gemessen (auch wenn's IMHO irgendwie komisch ist, auf den ersten Blick).]