0.0.1 ↑ Alkine
Allgemeine Formel: \text{C}_n\text{H}_{2n-2}, eine C≡C-Bindung im Molekül
Name: Wortstamm wie bei Alkanen, nur Endung -in
Homologe Reihe:
| Name | Summenformel | Strukturformel |
|---|---|---|
| Ethin | \text{C}_2\text{H}_2 | \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{H} & - & \text{C} & {\equiv} & \text{C} & - & \text{H} \end{array} |
| Propin | \text{C}_3\text{H}_4 | \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & & & & & \text{H} & & \\ {} & & & & & & | & & \\ {} \text{H} & - & \text{C} & {\equiv} & \text{C} & - & \text{C} & - & \text{H} \\ {} & & & & & & | & & \\ {} & & & & & & \text{H} & & \end{array} |
| Butin | \text{C}_4\text{H}_6 | \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & & & & & \text{H} & & \text{H} & & \\ {} & & & & & & | & & | & & \\ {} \text{H} & - & \text{C} & {\equiv} & \text{C} & - & \text{C} & - & \text{C} & - & \text{H} \\ {} & & & & & & | & & | & & \\ {} & & & & & & \text{H} & & \text{H} & & \end{array} |
Isomere:
Keine cis/trans-Isomerie
Je nach Lage der Doppelbindung verschiedene Isomere
Z.B. 1-Butin, 2-Butin
→ Weniger Isomere möglich als bei Alkenen
0.0.1.1 ↑ Bindungszustände in der Dreifachbindung
C-Atome in anderem Hybridisierungszustand: Zwei sp-Hybridorbitale und zwei p-Orbitale!
[1s² 2sp-Hybrid² 2p²]
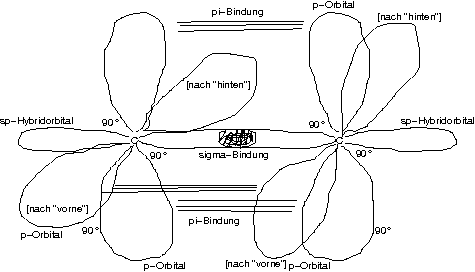
[Und bei den beiden hinteren Teilen der p-Orbitale auch noch Bindung]
Dreifachbindung bestehend aus
\sigma-Bindung (sp/sp) und
zwei \pi-Bindungen (p/p)
0.0.1.2 ↑ Alkine und ihre Eigenschaften
Physikalische Eigenschaften:
- Schmelzpunkt/Siedepunkt
Grundlage V.d.W.-Kräfte
Je mehr V.d.W.-Kräfte, desto höher der Siedepunkt.
- Hexan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \\ {} & \text{C} & & & & \text{C} & & & & \text{C} & & & \\ {} \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup \\ {} & & & \text{C} & & & & \text{C} & & & & \text{C} & \\ {} & & \diagup & & \diagdown & & \diagup & & \diagdown & & \diagup & & \diagdown \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} / & \backslash{} & / & \backslash{} & / & \backslash{} \\ {} / & \backslash{} & / & \backslash{} & / & \backslash{} \end{array}
"Viele" V.d.W.-Kräfte – "hoher" Siedepunkt
- Hexen
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \diagdown & & \diagup & & \diagdown & & & & \diagup & & \diagdown & & \diagup \\ {} & \text{C} & & & & \text{C} & = & \text{C} & & & & \text{C} & \\ {} \diagup & & \diagdown & & \diagup & & & & \diagdown & & \diagup & & \diagdown \\ {} & & & \text{C} & & & & & & \text{C} & & & \\ {} & & \diagup & & \diagdown & & & & \diagup & & \diagdown & & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & & \texttt{\_{}} & \texttt{\_{}} & & \\ {} \backslash{} & / & & & \backslash{} & / \\ {} / & \backslash{} & \texttt{\_{}} & \texttt{\_{}} & / & \backslash{} \end{array}
Wenig V.d.W.-Kräfte – niedriger Siedepunkt
- Hexin
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & | & & & & & & & \\ {} - & \text{C} & - & & & & & & \\ {} & | & & & & & & | & \\ {} - & \text{C} & - & \text{C} & {\equiv} & \text{C} & - & \text{C} & - \\ {} & | & & & & & & | & \\ {} & & & & & & - & \text{C} & - \\ {} & & & & & & & | & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & & / & \backslash{} & / & \backslash{} \\ {} \backslash{} & / & \backslash{} & / & & \end{array}
Etwas mehr V.d.W. → etwas höherer Siedepunkt [als Hexen IIRC]
- Viskosität
Die Viskosität nimmt im Vergleich zu den Alkenen wieder etwas zu. Begründung: V.d.W.-Kräfte [wie bei Siedepunkt/Schmelzpunkt]
- Löslichkeit
Alle [Alkane, Alkene, Alkine] sind hydrophob, daher "keine" Löslichkeit [die kleinen Alkine schon eher, aber sehr sehr wenig immer noch] in Wasser, gute Löslichkeit in Alkanen, Alkenen, Alkinen und anderen unpolaren Lösungsmitteln.
Chemische Eigenschaften:
- Brennbarkeit
Alle Alkine sind brennbar:
\text{C}_3\text{H}_4 + 3\,\text{O}_2 \longrightarrow 2\,\text{CO}_2 + 2\,\text{H}_2\text{O} + \text{C} (+\, \text{C} da unvollständige Verbrennung (hoher C-Anteil [pro Molekül])
Energetische Betrachtung der Verbrennungsreaktionen von Kohlenwasserstoffen:
Freisetzung von Energie nimmt zu: Alkan < Alken < Alkin
Da Doppelbindungen und Dreifachbindungen mehr Energie bei ihrer Trennung freisetzen, liefern Alkene und Alkine mehr Energie bei ihrer vollständigen Verbrennung.
[Wenn die Verbrennung nicht optimal ist, dann hat man wieder weniger davon, weil dann ja noch elementarer Kohlenstoff entsteht und da geht dann irgendwie auch 'nen Teil der Energie hin oder so...]
[Beispiel: Ethin mit reinem Sauerstoff zur Erzeugung heißer Flammen für Schienenfixung]
0.0.1.3 ↑ Additionsreaktionen
Beispiel: Ethin addiert Brom
{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccccc} {} \text{H} & & & & & & & & & \\ {} | & & & & & & & & & \\ {} \text{C} & & & & & & \delta^+ & & \delta^- & \\ {} \vert\vert\vert{} & \cdot & \cdot & \cdot & \cdot & | & \underline{\overline{\text{Br}}} & - & \underline{\overline{\text{Br}}} & | \\ {} \text{C} & & & & & & & & & \\ {} | & & & & & & & & & \\ {} \text{H} & & & & & & & & & \end{array} } \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} \text{H} & & & \\ {} | & & & \\ {} \text{C} & & & \\ {} \vert\vert{} & \backslash{} & & \backslash{} \\ {} \vert\vert{} & & \text{Br}^\oplus & \\ {} \vert\vert{} & / & & / \\ {} \text{C} & & & \\ {} | & & & \\ {} \text{H} & & & \end{array} } + \text{Br}^\ominus}_{\begin{array}{c}\scriptsize\text{Rückseitenangriff}\\\scriptsize\text{des }|\underline{\overline{\text{Br}}}|^\ominus\end{array}} \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H} & & & & \underline{\overline{\text{Br}}}| \\ {} & \backslash{} & & / & \\ {} & & \text{C} & & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & / & & \backslash{} & \\ {} |\underline{\overline{\text{Br}}} & & & & \text{H} \end{array} }
[Es entsteht] Trans-1,2-dibromethen
[Führt man noch] weitere Additionen [durch, so erhält man] \text{C}_2\text{H}_2\text{Br}_4 (1,1,2,2-Tetrabromethen). Nur dieses kann sich aus Ethin über Addition (mittels Rückseitenangriff) bilden.
\underbrace{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} \text{H} & & & & & & & & \\ {} | & & & & & & & & \\ {} \text{C} & & & & & \delta^+ & & \delta^- & \\ {} \vert\vert\vert{} & \cdot & \cdot & \cdot & \cdot & \text{H} & - & \underline{\overline{\text{Cl}}} & | \\ {} \text{C} & & & & & & & & \\ {} | & & & & & & & & \\ {} \text{H} & & & & & & & & \end{array} }_{\text{Elek\-tro\-phi\-ler An\-griff}} \longrightarrow \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} \text{H} & & \\ {} | & & \\ {} \text{C} & & \\ {} \vert\vert{} & \backslash{} & \\ {} \vert\vert{} & & \text{H}^\oplus \\ {} \vert\vert{} & / & \\ {} \text{C} & & \\ {} | & & \\ {} \text{H} & & \end{array} + \text{Cl}^\ominus \longrightarrow \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H} & & & & \text{H} \\ {} & \backslash{} & & / & \\ {} & & \text{C} & & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & / & & \backslash{} & \\ {} |\underline{\overline{\text{Cl}}} & & & & \text{H} \end{array} {\renewcommand{\arraystretch}{0.5}\begin{array}{c}\scriptsize\text{weitere}\\\longrightarrow\\\scriptsize\text{Addition}\end{array}} \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H} & & & & \text{Cl} \\ {} & \backslash{} & & / & \\ {} & & \text{C} & & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & / & & \backslash{} & \\ {} \text{Cl} & & & & \text{H} \end{array}
1-Chlorethen:
{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} \text{H} & & & & & & & \\ {} | & & & & & & & \\ {} \text{C} & & & & & \delta^+ & & \delta^- \\ {} \vert\vert\vert{} & \cdot & \cdot & \cdot & \cdot & \text{H} & - & \text{A} \\ {} \text{C} & & & & & & & \\ {} | & & & & & & & \\ {} \text{H} & & & & & & & \end{array} } \longrightarrow \begin{array}{l} { \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} \text{H} & & \\ {} | & & \\ {} \text{C} & & \\ {} \vert\vert{} & \backslash{} & \\ {} \vert\vert{} & & ^\oplus\text{H} \\ {} \vert\vert{} & / & \\ {} \text{C} & & \\ {} | & & \\ {} \text{H} & & \end{array} } + |\underline{\overline{\text{A}}}|^\ominus \quad \text{unwahrscheinlich} \\ \ \\\text{oder (XXX?)}\\\ \\ { \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} \text{H} & & \\ {} | & & \\ {} \text{C} & - & \text{H} \\ {} \vert\vert{} & & \\ {} \text{C} & ^\oplus & \\ {} | & & \\ {} \text{H} & & \end{array} } + |\underline{\overline{\text{A}}}|^\ominus \end{array}
Carbeniumion (Kohlenstoffatom mit positiver Ladung)
Es existieren verschiedene Carbeniumionen, die sich in ihrer Stabilität unterscheiden:
| Name | Strukturformel | Ausgangsstoff |
|---|---|---|
| Primäres Carbeniumion | \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{CH}_3 & - & \text{CH} & - & \text{CH}_3^\oplus \\ {} & & | & & \\ {} & & \text{H} & & \end{array} | \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & & & \text{H} \\ {} & & & & & / & \\ {} \text{CH}_3 & - & \text{C} & = & \text{C} & & \\ {} & & | & & & \backslash{} & \\ {} & & \text{H} & & & & \text{H} \end{array} \vspace*{1em} |
| Sekundäres Carbeniumion | \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{CH}_3 & - & \text{CH}^\oplus & - & \text{CH}_3 \end{array} | \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{CH}_3 & - & \text{C} & = & \text{CH}_2 \\ {} & & | & & \\ {} & & \text{H} & & \end{array} \vspace*{1em} |
| Tertiäres Carbeniumion | \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{CH}_3 & - & \text{C}^\oplus & - & \text{CH}_3 \\ {} & & | & & \\ {} & & \text{CH}_3 & & \end{array} | \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \text{CH}_3 \\ {} & & & / & \\ {} \text{H}_2\text{C} & = & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \text{CH}_3 \end{array} |
(Zunehmende Stabilität von oben nach unten [also tertiäres Carbeniumion ist stabiler als sekundäres, Grund: Kohlenstoffreste liefern Elektronen, um die positive Ladung zu stabilisieren (XXX)])
Weitere Besonderheiten bei Mehrfachbindungen:
\text{C}_4\text{H}_6 – Butin oder Buten:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} \backslash{} & & & & & | & & | & \\ {} & \text{C} & = & \text{C} & = & \text{C} & - & \text{C} & - \\ {} / & & & & & & & | & \\ {} & {\scriptsize\text{sp²}} & & {\scriptsize\text{sp}} & & {\scriptsize\text{sp²}} & & {\scriptsize\text{sp³}} & \end{array}
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} \backslash{} & & & | & & | & & & / \\ {} & \text{C} & = & \text{C} & - & \text{C} & = & \text{C} & \\ {} / & & & & & & & & \backslash{} \\ {} & {\scriptsize\text{sp²}} & & {\scriptsize\text{sp²}} & & {\scriptsize\text{sp²}} & & {\scriptsize\text{sp²}} & \end{array}
1,2,3-Hexatrien (kumulierte Doppelbindung):
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \backslash{} & & & & & & & | & & | & & | & \\ {} & \text{C} & = & \text{C} & = & \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & - \\ {} / & & & & & & & | & & | & & | & \end{array}
1,3,5-Hexatrien (konjugierte Doppelbindung):
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \backslash{} & & & | & & | & & | & & & & | & \\ {} & \text{C} & = & \text{C} & - & \text{C} & = & \text{C} & - & \text{C} & = & \text{C} & - \\ {} / & & & & & & & & & | & & | & \end{array}
1,4-Hexadien (isolierte Doppelbindung)
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \backslash{} & & & & & | & & & & | & & | & \\ {} & \text{C} & = & \text{C} & - & \text{C} & - & \text{C} & = & \text{C} & - & \text{C} & - \\ {} / & & & | & & | & & | & & & & | & \end{array}
Penta-1-en-3-in:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} \backslash{} & & & | & & & & & & | & \\ {} & \text{C} & = & \text{C} & - & \text{C} & {\equiv} & \text{C} & - & \text{C} & - \\ {} / & & & & & & & & & | & \end{array}