0.0.1 ↑ Aromaten
Einfachster Aromat ist das Benzol.
Summenformel: \text{C}_6\text{H}_6
Strukturformel:
[Prinzipiell wäre es 1,3,5-Cyclotrien, aber das gibt es wegen der dreifachen Überlappung nicht]
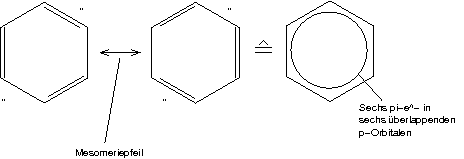
Mesomere Grenzformeln ["tatsächlich": irgendwo dazwischen]
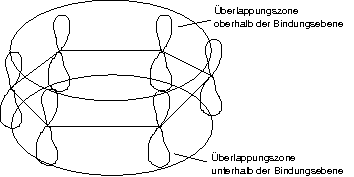
Das \pi-System des Rings ist äußerst stabil [nachweisbar durch Hydrierungsreaktionen].
Alle Aromaten besitzen ein derartiges \pi-System (überlappende p-Orbitale).
Das \pi-System ist nur dann äußerst stabil, wenn es \left(4n + 2\right) \pi-e^- enthält. [Beispiel für n = 2:]
Aromaten sind auch Moleküle, die einen Benzolring als Bestandteil enthalten (z.B. Adrenalin, Vanillin, ...).
0.0.1.1 ↑ Reaktionen der Aromaten
Das Reaktionsverhalten von Benzol gibt beispielhaft die Besonderheit aller Aromaten wieder.
Benzol im Vergleich zu anderen Kohlenwasserstoffen mit Doppelbindung:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} \backslash{} & & / & & & & & & & & \\ {} & \text{C} & & & & & & \delta^+ & & \delta^- & \\ {} & \vert\vert{} & \cdot & \cdot & \cdot & \cdot & | & \underline{\overline{\text{Br}}} & - & \underline{\overline{\text{Br}}} & | \\ {} & \text{C} & & & & & & & & & \\ {} / & & \backslash{} & & & & & & & & \end{array} }}_{\pi\text{-Komplex}} \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} \backslash{} & & / & \\ {} & \text{C} & & \\ {} & | & \backslash{} & \\ {} & | & & ^\oplus\text{Br} \\ {} & | & / & \\ {} & \text{C} & & \\ {} / & & \backslash{} & \end{array} }}_{\sigma\text{-Komplex}} (Additionsreaktion bei Alkenen; sofortige Reaktion!)
Benzol reagiert nicht spontan mit Brom (unter Addition); Beweis der Stabilität des Benzols!
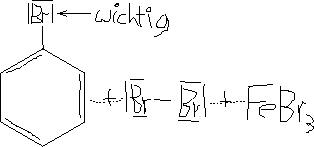
Mit Hilfe eines Katalysators erfolgt eine Reaktion zwischen Brom und Benzol.
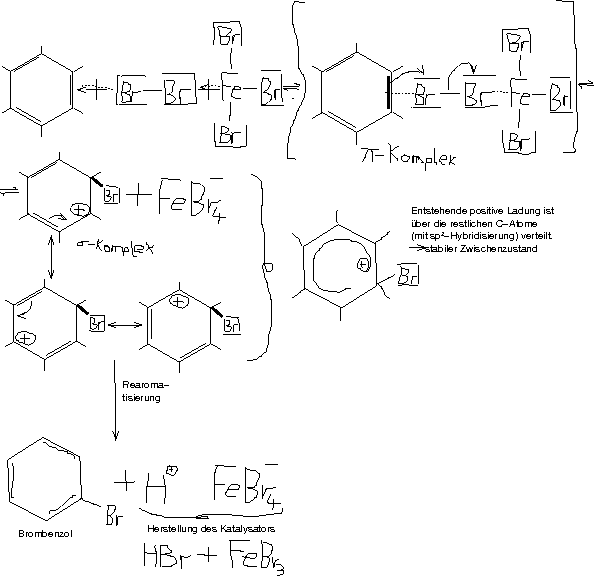
\text{Br}_2 + \text{C}_6\text{H}_6 \stackrel{\text{[FeBr}_3\text{]}}{\longrightarrow} \text{C}_6\text{H}_5\text{Br} + \text{HBr} (Elektrophile Substitution)
Energetische Betrachtung des Reaktionsverlaufs:
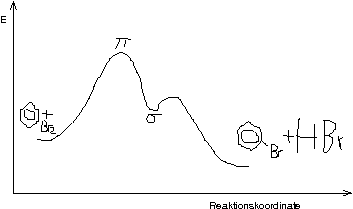
Nur bei der elektrophilen Substitution entsteht wieder ein aromatisches Produkt. Eine Addition im Gegenzug würde ein nicht-aromatisches und damit energetisch ungünstiges Produkt liefern.
Zweitsubstitution:
Je nach Effekt
-I-Effekt (zieht e^- "aus" Ring; [Sachen mit höherer Elektronegativität]) → erschwerte [Zweit-]Substitution
+I-Effekt (schiebt e^- in Ring; [Sachen mit niedrigerer Elektronegativität]) → erleichterte [Zweit-]Substitution
Weitere Beispiele für Einflüsse auf die Zweitsubstitution:
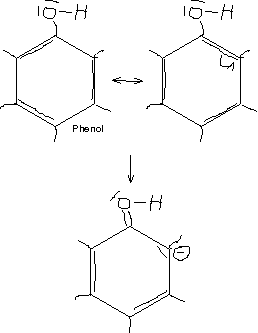
\text{OH}-Gruppe mit -I-Effekt; wegen positiven mesomeren Effekt trotzdem leichtere Zweitsubstitution [die selbe Argumentation mit Br geht nicht, weil Br keine Doppelbindung ausbildet, IMHO/IIRC]
[Vereinfachung der Zweitsubstitution wegen der negativen Ladung – und genügend negative Ladungen ist ja gerade Voraussetzung für die elektrophile Substitution]
Mögliche Produkte einer Zweitsubstitution:
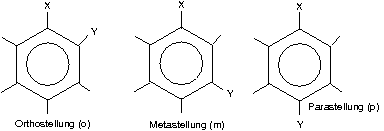
Beispiel o-Dibrombenzol [man könnte auch 1,2-Dibrombenzol sagen, aber o-/n-/p- ist kürzer]:
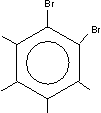
[Kondensierte Aromaten ← gemeinsames System]
[Heteroaromaten ← nicht nur C-Atome, sondern auch andere Atome möglich; nur müssen sie halt das System herstellen können]
[Heteroaromaten können auch (z.B.) 5-Ringe sein; die nicht-C-Atome bringen dann jeweils ein Elektronenpaar mit]
[B. S. 53 ← Übersicht über die Einteilung der Kohlenwasserstoffe]
[Gesättigt ← an jedem C-Atom befindet sich die maximale Anzahl an Bindungen, z.B. \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} & & \text{H} & \\ {} & & | & \\ {} \text{H} & - & \text{C} & - \\ {} & & | & \\ {} & & \text{H} & \end{array} (am Ende) oder \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} & \text{H} & \\ {} & | & \\ {} - & \text{C} & - \\ {} & | & \\ {} & \text{H} & \end{array} (drinnen)]
[Gesättigte Kohlenwasserstoffe ← recht träge, was Reaktionen angeht (u.a. wegen der Notwendigkeit von radikalischer Substitution etc.)]
[Den Ausdruck "Substitution" nutzt man deswegen, weil das \pi-System ja erhalten bleibt]
[B. S. 142 ← Übersicht über die verschiedenen Reaktionstypen]