0.0.1 ↑ Grundwissen
- Alkane
Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (\sigma-Bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen.
Die allgemeine Formel der Alkane lautet \text{C}_n\text{H}_{2n+2}.
Alle Kohlenstoffatome sind sp³-hybridisiert.
- Alkene
Ungesättigte Kohlenwasserstoffe, die zwischen den Kohlenstoffatomen im Molekül eine Doppelbindung (eine \sigma-Bindung, eine \pi-Bindung) aufweisen.
Die allgemeine Formel lautet \text{C}_n\text{H}_{2n}.
Die Kohlenstoffatome der Doppelbindungen sind sp²-hybridisiert.
- Alkine
Ungesättigte Kohlenwasserstoffe, die zwischen den Kohlenstoffatomen im Molekül eine Dreifachbindung (eine \sigma-Bindung, zwei \pi-Bindungen) aufweisen.
Die allgemeine Formel lautet \text{C}_n\text{H}_{2n-2}.
Die Kohlenstoffatome der Dreifachbindungen sind sp-hybridisiert.
- \sigma-Bindung
Überlappung von je einem sp³-Hybridorbital zweier Kohlenstoffatome bzw. eines sp³-Hybridorbitals eines Kohlenstoffatoms und eines s-Orbitals eines Wasserstoffatoms.
- \pi-Bindung
Überlappung von je zwei p-Orbitalen zweier Kohlenstoffatome oberhalb und unterhalb der Kernbindungsachse.
- Konstitutionsisomerie
Konstitutionsisomerie liegt vor bei Molekülen gleicher Summenformel, aber unterschiedlicher Anordnung (Struktur) der Atome.
Beispiel: \text{C}_4\text{H}_{10}:
- Konformationsisomerie
Die durch Drehung um \sigma-Bindungen möglichen räumlichen Anordnungen der Atome werden als Konformationen eines Moleküls bezeichnet.
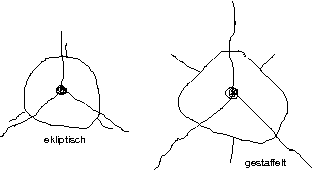
- cis-trans-Isomerie
cis-trans-Isomerie liegt aufgrund der nichtvorhandenen freien Drehbarkeit der Doppelbindung vor:
- cis-Dichlorethan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{H} & & & & & & \text{H} \\ {} & \backslash{} & & & & / & \\ {} & & \text{C} & = & \text{C} & & \\ {} & / & & & & \backslash{} & \\ {} \text{Br} & & & & & & \text{Br} \end{array}
- trans-Dichlorethan
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{Br} & & & & & & \text{H} \\ {} & \backslash{} & & & & / & \\ {} & & \text{C} & = & \text{C} & & \\ {} & / & & & & \backslash{} & \\ {} \text{H} & & & & & & \text{Br} \end{array}
- Elektrophile Addition
Reaktionsmechanismus der Anlagerung eines Moleküls an die Doppelbindung eines Alkens. Dabei werden sp²-hybridisierte C-Atome zu sp³-hybridisierten.
Elektrophile Addition läuft in zwei Schritten ab:
Elektrophiler Angriff eines Kations oder positiv polarisierten Teilchens
Rückseitenangriff des Anions
- Aromaten
Moleküle, die
einen ebenen bzw. nahezu ebenen Ring mit
einer ringförmig geschlossenen delokalisierten \pi-Elektronenwolke mit
4n + 2 \pi-Elektronen (n = 1, 2, 3, \ldots, Hückel-Regel) bilden.
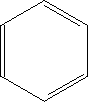
- Delokalisiertes \pi-Elektronensystem
Die \pi-Bindungselektronen sind nicht zwischen zwei C-Atomen lokalisiert, sondern über das ganze System verteilt.
Beispiel: Benzol:
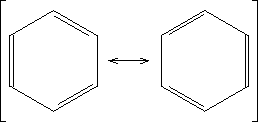
- Mesomerie
Mesomerie beschreibt den tatsächlich vorliegenden Zustand eines Moleküls, der nur durch sogenannte Grenzstrukturen beschrieben werden kann.
- Alkohole
Organische Moleküle mit mindestens einer Hydroxylgruppe.
- Primäre Alkohole
Endständige Hydroxylgruppe, z.B. Ethanol
- Sekundäre Alkohole
Z.B. Propan-2-ol
- Tertiäre Alkohole
Z.B. 2-Methylpropan-2-ol
- Phenole
Aromaten mit mindestens einer Hydroxylgruppe am aromatischen Ring, z.B. Phenol = Hydroxybenzol
- Carbonylverbindungen
Carbonylverbindungen enthalten eine Carbonylgruppe (\text{C}{=}\text{O}) im Molekül. Dazu gehören Aldehyde (z.B. Ethanal \text{H}_3\text{C}\text{CHO}) und Ketone (z.B. Aceton \text{H}_3\text{C}\text{CO}\text{CH}_3). Das C-Atom der Carbonylgruppe ist positiv polarisiert.
\left[{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \overline{\text{O}}| \\ {} & & & /\!/ & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \text{H} \end{array} } \longleftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \underline{\overline{\text{O}}}|^\ominus \\ {} & & _\oplus & /\!/ & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \text{H} \end{array} }\right]
- Fehlingprobe
Nachweisreaktion für Alkane durch Mischung von:
Fehling I (\text{CuSO}_4-Lösung) und Fehling II (K/Na-Tartrat-Lösung und NaOH-Lösung). Bei Erwärmen mit einem Aldehyd wird dieses oxidiert und die \text{Cu}^{2+}-Ionen zu rotem \text{Cu}_2\text{O} reduziert.
- Silberspiegelprobe (Tollens)
Ammoniakalische Silbernitratlösung wird zusammen mit dem Aldehyd erwärmt. Die \text{Ag}^+-Ionen werden zu \text{Ag}-Atomen (elementarem Silber) reduziert (Silberbeschlag am Glas).
- Nucleophile Addition
Addition eines Anions oder negativ polarisierten Moleküls an das C-Atom der Carbonylgruppe (z.B. Hydratbildung bzw. Halbacetal- und Vollacetalbildung).
- Carbonsäuren
Organische Moleküle mit mindestens einer Carboxygruppe COOH.
Durch Mesomeriestabilisierung des Carboxylations sind Carbonsäuren schwach sauer.
\left[{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \overline{\text{O}}| \\ {} & & & /\!/ & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & |\underline{\text{O}}|_\ominus \end{array} } \longleftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & |\overline{\text{O}}|^\ominus \\ {} & & & / & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash\!\backslash & \\ {} & & & & \underline{\text{O}}| \end{array} }\right]
[XXX: Das ist doch einfach eine Drehung um \sigma-Bindung, nicht? – Nein.]
- Chiralität (Händigkeit)
Ein Kohlenstoffatom, welches vier verschiedene Substituenten trägt, bezeichnet man als asymmetrisch.
Verbindungen mit asymmetrische(n) C-Atom(en) sind chiral. Verhalten sich chirale Verbindungen wie Bild und Spiegelbild zueinander, spricht man von Enantiomerie oder Spiegelbildisomerie.
- Ester
Durch Kochen von Carbonsäuren mit Alkoholen in Gegenwart von konzentrierter Schwefelsäure erhält man wasserunlösliche Flüssigkeiten, sog. Ester.
Ester können umgekehrt mit Wasser wieder zu den Ausgangsstoffen reagieren. Man spricht von Esterhydrolyse.
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{R}_1 & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & |\underline{\text{O}} & - & \text{H} \end{array} } + { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H} & - & \overline{\underline{\text{O}}} & - & \text{R}_2 \end{array} } { \setlength{\arraycolsep}{0pt} \begin{array}{c} {} \text{\scriptsize Esterbildung }\left[\text{\scriptsize H}^+\right] \\ {} \longleftrightarrow \\ {} \text{\scriptsize /Esterhydrolyse} \end{array} } { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{R}_1 & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & |\underline{\text{O}} & - & \text{R}_2 \end{array} } + \text{H}_2\text{O}
- Optische Aktivität
Optisch aktive Verbindungen sind chiral und drehen die Schwingungsebene des linear polarisierten Lichts um einen bestimmten Winkel (Drehwert).
- Fischerprojektion
Darstellungsform nicht zyklischer Aldosen, Ketosen und ähnlicher Moleküle: Vertikale Anordnung der Kohlenstoffatome, C-Atom mit der höchsten Oxidationszahl nach oben. Alle Atome werden in die Zeichenebene projiziert. Die mit dem Chiralitätszentrum \text{C}^+ verbundenen Atome, die oben und unten stehen, liegen hinter der Zeichenebene, die links und rechts stehen liegen vor der Zeichenebene.
D-Form: Hydroxylgruppe am unteren asymmetrisch C-Atom zeigt nach rechts.
L-Form: Hydroxylgruppe am unteren asymmetrisch C-Atom zeigt nach links.
- Haworth-Formeln
Darstellungsform zyklischer Aldosen, Ketosen und ähnlicher Moleküle, z.B. Pyranosen und Furanosen.
An asymmetrischen C-Atomen in der Fischerprojektion nach rechts zeigende Hydroxylgruppen zeigen nach unten.
- Glykosidische Bindung
Sauerstoffbindung zwischen dem anomeren C-Atom einer Pyranose/Furanose und einem C-Atom eines anderen Moleküls. Entsteht durch säurekatalysierte Wasserabspaltung aus zwei Hydroxylgruppen.
\alpha (\beta)-glykosidische Bindung: Am anomeren C-Atom zeigt sie in Haworth-Projektion nach unten (oben).
- \alpha-Aminosäuren
2-Aminocarbonsäuren.
Aus bis zu zwanzig unterschiedlichen L-Aminosäuren können Proteine aufgebaut sein.
- Peptidbindung
Entsteht durch Wasserabspaltung zwischen [der] Carboxylgruppe einer Aminosäure und der \alpha-Aminogruppe einer anderen Aminosäure.
Eigenschaften: Planar
\left[{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{R}_2 & & & & \text{H} & & \\ {} & \backslash{} & & & | & & \\ {} & & \text{C} & - & \underline{\text{N}} & & \\ {} & & \vert\vert{} & & & \backslash{} & \\ {} & & |\text{O}| & & & & \text{R}_1 \end{array} } \longleftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{R}_2 & & & & \text{H} & & \\ {} & \backslash{} & & & | & & \\ {} & & \text{C} & = & \text{N}^\oplus & & \\ {} & & | & & & \backslash{} & \\ {} & & _\ominus|\underline{\text{O}}| & & & & \text{R}_1 \end{array} }\right]
- Fette und Öle
Fette sind Tri-Ester aus langkettigen Carbonsäuren (Fettsäuren) und dem dreiwertigen Alkohol Glyzerin (Propantriol).
Sind die Fettsäuren ungesättigt, so sinkt der Schmelzbereich dieses Fettes. Fette Öle sind bei Raumtemperatur flüssig.