0.0.1 ↑ Kohlen(stoff)hydrate
[Schlussfolgerungen der Versuche:
Trauben- und Rohrzucker enthalten \text{H}_2\text{O}.
Bei Versetzung mit Schwefelsäure entsteht elementarer Kohlenstoff.
Trauben- und Rohrzucker sind polar.
Traubenzucker ist oxidierbar (mittels Fehling- und Silberspiegelprobe) → Traubenzucker enthält eine Aldehydgruppe.
Rohrzucker ist nicht oxidierbar (mittels Fehling- und Silberspiegelprobe).]
\text{C}_m\text{H}_{2n}\text{O}_n
→ Summenformel: \text{C}_m\!\left(\text{H}_2\text{O}\right)_n
Beispiele: Glycose, Saccharose, Watte, Mehl
Die verschiedenen Kohlenhydrate werden nach der Anzahl ihrer Bausteine z unterteilt.
- a)
Monosaccharide: Einfachzucker; z = 1
- b)
Disaccharide: Zweifachzucker; z = 2
- c)
Oligosaccharide: Mehrfachzucker; z von 3–10
- d)
Polysaccharide: Vielfachzucker; z von 10–100.000
0.0.1.1 ↑ Monosaccharide
[Beispiel: Vollständige Verbrennung von Glycose: \text{C}_6\text{H}_{12}\text{O}_6 + 6\,\text{O}_2 \longrightarrow 6\,\text{H}_2\text{O} + 6\,\text{CO}_2]
Man unterteilt in:
- a)
\overbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & \text{H} & & & & \overline{\text{O}}| & & \\ {} & & \backslash{} & & /\!/ & & & \\ {} & & & \text{C} & & & & \\ {} & & & | & & & & \\ {} ( & \text{H} & - & \text{C} & - & \text{O} & \text{H} & )_n \\ {} & & & | & & & & \\ {} & & \text{H}_2 & \text{C} & \text{O} & \text{H} & & \end{array} }}^{\text{Aldosen}} \text{ und } \overbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & \text{H}_2 & \text{C} & \text{O} & \text{H} & & \\ {} & & & | & & & & \\ {} & & & \text{C} & = & \text{O}^\backslash_/ & & \\ {} & & & | & & & & \\ {} ( & \text{H} & - & \text{C} & - & \text{O} & \text{H} & )_{n-1} \\ {} & & & | & & & & \\ {} & & \text{H}_2 & \text{C} & \text{O} & \text{H} & & \end{array} }}^{\text{Ketosen}}
- b)
Nach der Anzahl der C-Atome
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{H} & & & & \overline{\text{O}}| & \\ {} & \backslash{} & & /\!/ & & \\ {} & & \text{C} & & & \\ {} & & | & & & \\ {} \text{H} & - & \text{C} & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} & \text{H}_2 & \text{C} & - & \text{O} & \text{H} \end{array} }}_{\scriptsize\begin{array}{c}\text{Aldotriose}\\\text{2,3-Dihydroxy-}\\\text{propanol}\\\text{C}_3\text{H}_6\text{O}_3\end{array}} \stackrel{\text{Konstitutionsisomerie}}{\longleftrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & \text{H}_2 & \text{C} & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} & & \text{C} & = & \text{O}^\backslash_/ & \\ {} & & | & & & \\ {} & \text{H}_2 & \text{C} & - & \text{O} & \text{H} \end{array} }}_{\scriptsize\begin{array}{c}\text{Ketotriose}\\\text{1,3-Dihydroxypropanon}\\\text{C}_3\text{H}_6\text{O}_3\end{array}}
H O ¯ ∣ ∖ ∕ ∕ C ∣ H − C − O H ∣ H 2 C − O H ︸ Aldotriose 2,3-Dihydroxy- propanol C 3 H 6 O 3 ↔ Konstitutionsisomerie H 2 C − O H ∣ C = O ∕ ∖ ∣ H 2 C − O H ︸ Ketotriose 1,3-Dihydroxypropanon C 3 H 6 O 3 [Wenn das C mit der Nummer 1 (nach der "das C-Atom, was am höchsten oxidiert ist, ist Nummer 1"-Regel), nicht am Kettenende steht, gilt die Regel nicht und die normale Streubert-Regel setzt wieder ein.]
0.0.1.1.1 ↑ Stereoisomerie
Unterschiedliche räumliche Anordnung der Atomgruppen der Moleküle bei gleicher Reihenfolge und Verknüpfungsart.
Enantiomere:
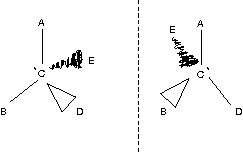
Die beiden Stereoisomere verhalten sich wie Bild und Spiegelbild.
Glycerinaldehyd:
Enantiomere treten auf, wenn das Molekül ein C-Atom mit vier verschiedenen Substituenten enthält.
→ Asymmetrisches C-Atom
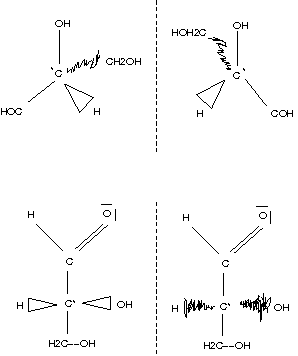
Aldotetraose
\setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{H} & & & & \overline{\text{O}}| & \\ {} & \backslash{} & & /\!/ & & \\ {} & & \text{C} & & & \\ {} & & | & & & \\ {} \text{H} & - & \text{C}^* & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} \text{H} & - & \text{C}^* & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} & \text{H}_2 & \text{C} & - & \text{O} & \text{H} \end{array}
H O ¯ ∣ ∖ ∕ ∕ C ∣ H − C ∗ − O H ∣ H − C ∗ − O H ∣ H 2 C − O H Weinsäure (2,3-Dihydroxy-butandisäure)
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccccc} {} \text{H} & \text{O} & & & & \overline{\text{O}}| & & & & & & |\overline{\text{O}} & & & & \text{O} & \text{H} & & & \\ {} & & \backslash{} & & /\!/ & & & & & & & & \backslash{} & & /\!/ & & & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & & & \\ {} & & & | & & & & & & & & & & | & & & & & & \\ {} & & - & \text{C}^* & - & \text{O} & \text{H} & & & & \text{H} & \text{O} & - & \text{C}^* & - & & & & & \\ {} & & & | & & & & & {\qquad\stackrel{\text{identisch}}{\longleftrightarrow}\qquad\ } & & & & & | & & & & & & \qquad\text{Meso-Formen} \\ {} & & - & \text{C}^* & - & \text{O} & \text{H} & & & & \text{H} & \text{O} & - & \text{C}^* & - & & & & & \\ {} & & & | & & & & & & & & & & | & & & & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & & & \\ {} & & / & & \backslash\!\backslash & & & & & & & & / & & \backslash\!\backslash & & & & & \\ {} & |\underline{\text{O}} & & & & \text{O} & \text{H} & & & & \text{H} & \text{O} & & & & \underline{\text{O}}| & & & & \\ {} & & & {\ } & & & & & & & & & & & & & & & & \\ {} & & & {\ } & & & & & & & & & & & & & & & & \\ {} & & & \updownarrow & & & & & \nearrow\!\!\!\!\!\!\swarrow\!\!\!\!\!\!\nwarrow\!\!\!\!\!\!\searrow & & & & & \updownarrow & & & & & & \qquad\text{Diastereomere} \\ {} & & & {\ } & & & & & & & & & & & & & & & & \\ {} & & & {\ } & & & & & & & & & & & & & & & & \\ {} \text{H} & \text{O} & & & & \overline{\text{O}}| & & & & & & |\overline{\text{O}} & & & & \text{O} & \text{H} & & & \\ {} & & \backslash{} & & /\!/ & & & & & & & & \backslash{} & & /\!/ & & & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & & & \\ {} & & & | & & & & & & & & & & | & & & & & & \\ {} \text{H} & \text{O} & - & \text{C}^* & - & & & & & & & & - & \text{C}^* & - & \text{O} & \text{H} & & & \\ {} & & & | & & & & & {\qquad\stackrel{\text{enantiomer}}{\longleftrightarrow}\qquad\ } & & & & & | & & & & & & \\ {} & & - & \text{C}^* & - & \text{O} & \text{H} & & & & \text{H} & \text{O} & - & \text{C}^* & - & & & & & \\ {} & & & | & & & & & & & & & & | & & & & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & & & \\ {} & & / & & \backslash\!\backslash & & & & & & & & / & & \backslash\!\backslash & & & & & \\ {} & |\underline{\text{O}} & & & & \text{O} & \text{H} & & & & \text{H} & \text{O} & & & & \underline{\text{O}}| & & & & \end{array}
H O O ¯ ∣ ∣ O ¯ O H ∖ ∕ ∕ ∖ ∕ ∕ C C ∣ ∣ − C ∗ − O H H O − C ∗ − ∣ ↔ identisch ∣ Meso-Formen − C ∗ − O H H O − C ∗ − ∣ ∣ C C ∕ ∖ ∖ ∕ ∖ ∖ ∣ O ¯ O H H O O ¯ ∣ ↕ ↗ ↙ ↖ ↘ ↕ Diastereomere H O O ¯ ∣ ∣ O ¯ O H ∖ ∕ ∕ ∖ ∕ ∕ C C ∣ ∣ H O − C ∗ − − C ∗ − O H ∣ ↔ enantiomer ∣ − C ∗ − O H H O − C ∗ − ∣ ∣ C C ∕ ∖ ∖ ∕ ∖ ∖ ∣ O ¯ O H H O O ¯ ∣
Festlegung: Stereoisomere Moleküle
Bei n
n 2 n 2 n Spiegelbildisomerie liegt vor, wenn innerhalb des Moleküls keine Symmetrieebenen vorliegen.
Diastereomere sind Stereoisomere, die keine Enantiomere sind. Sie haben unterschiedliche physikalische Eigenschaften.
Meso-Formen besitzen eine Symmetrieebene innerhalb des Moleküls und sind optisch inaktiv.
Glucose
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccccccccc} {} & & & \text{H} & & & & \overline{\text{O}}| & & & & & & {\ \ \ } & | & {\ \ \ } & & & |\overline{\text{O}} & & & & \text{H} & \\ {} & & & & \backslash{} & & /\!/ & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & \backslash\!\backslash & & / & & \\ {} & & & & & \text{C} & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & \text{C} & & & \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & & & - & \text{C}^* & - & \text{O} & \text{H} & & \text{ ta} & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C}^* & - & & \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} \text{tü } & & \text{H} & \text{O} & - & \text{C}^* & - & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & - & \text{C}^* & - & \text{O} & \text{H} \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & & & - & \text{C}^* & - & \text{O} & \text{H} & & \text{ ta} & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C}^* & - & & \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & & & - & \text{C}^* & - & \text{O} & \text{H} & & \text{ ta} & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C}^* & - & & \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & & & - & \text{C} & - & \text{O} & \text{H} & & & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C} & - & & \\ {} & & & & & | & & & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \end{array}
H O ¯ ∣ ∣ ∣ O ¯ H ∖ ∕ ∕ ∣ ∖ ∖ ∕ C ∣ C ∣ ∣ ∣ − C ∗ − O H ta ∣ H O − C ∗ − ∣ ∣ ∣ t H O − C ∗ − ∣ − C ∗ − O H ∣ ∣ ∣ − C ∗ − O H ta ∣ H O − C ∗ − ∣ ∣ ∣ − C ∗ − O H ta ∣ H O − C ∗ − ∣ ∣ ∣ − C − O H ∣ H O − C − ∣ ∣ ∣ Mannose [links: D-Mannose, rechts: L-Mannose]
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccccc} {} & & & \text{C} & \text{H} & \text{O} & & & & {\ \ \ } & | & {\ \ \ } & & & & & \text{C} & \text{H} & \text{O} & \\ {} & & & | & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C}^* & - & & & & & {\ \ \ } & | & {\ \ \ } & & & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C}^* & - & & & & & {\ \ \ } & | & {\ \ \ } & & & & - & \text{C}^* & - & \text{O} & \text{H} \\ {} & & & | & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & - & \text{C}^* & - & \text{O} & \text{H} & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C}^* & - & & \\ {} & & & | & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & - & \text{C}^* & - & \text{O} & \text{H} & & & {\ \ \ } & | & {\ \ \ } & & \text{H} & \text{O} & - & \text{C}^* & - & & \\ {} & & & | & & & & & & {\ \ \ } & | & {\ \ \ } & & & & & | & & & \\ {} & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & {\ \ \ } & | & {\ \ \ } & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} \end{array}
C H O ∣ C H O ∣ ∣ ∣ H O − C ∗ − ∣ − C − O H ∣ ∣ ∣ H O − C ∗ − ∣ − C ∗ − O H ∣ ∣ ∣ − C ∗ − O H ∣ H O − C ∗ − ∣ ∣ ∣ − C ∗ − O H ∣ H O − C ∗ − ∣ ∣ ∣ C H 2 O H ∣ C H 2 O H
[Spiegelbildisomere (Enantiomere) gibt's (wenn überhaupt) immer nur eins, Diastereoisomere kann's mehr geben.]
0.0.1.2 ↑ Fischerprojektion
[Verwendet man gestrichelte Linien, gilt: Gestrichelte Linien bedeuten "nach hinten", Keile "nach vorne". Die punktförmigen Keilenden setzt man an den Zentralatomen an.]
[Bei der Fischerprojektion gilt: Senkrechte Striche bedeuten "nach hinten", waagrechte "nach vorn". Bei der Fischerprojektion steht das höchstoxidierte C-Atom oben.]
[Zeigt die Hydroxylgruppe am letzten asymmetrischen C-Atom (in der Fischerprojektion unten) nach rechts, erhält das betreffende Molekül das Prefix "D-". Zeigt die Hydroxylgruppe nach links, setzt man "L-" vor den Molekülnamen.]
[Der Drehwinkel ist unabhängig von der "D-" bzw. "L-Heit".]
In der Natur kommen nur Zuckermoleküle mit D-Konfiguration vor.
[Fischerprojektion] zur Festlegung der Konfiguration der Substituenten am \text{C}^*
C-Kette senkrecht stellen, höchstoxidiertes C-Atom nach oben.
\text{C}^*
C ∗ \text{C}{-}\text{C}
C − C Bindungen, die nach rechts und links dargestellt werden, weisen aus der Papierebene heraus.
[Enthält ein Molekül eine Symmetrieebene, ist nicht chiral, auch, wenn es asymmetrische C-Atome an. Diese Symmetrieebene darf auch durch ein C gehen, beispielsweise bei \text{CH}_3{-}\text{CHOH}{-}\text{CH}_3
[Die Fischerprojektion gibt's nur bei Zuckern.]
[Ist die Position einer OH-Gruppe nicht im Molekülnamen angegeben, so befindet sie sich an C-Atom 1.]
[Übungsaufgabe:] Durch Oxidation von Glycerin kann man Kohlenhydrate erhalten, die alle die Summenformel \text{C}_3\text{H}_6\text{O}_3
0.0.1.2.2 ↑ Glucose (Traubenzucker, Dextrose)
Summenformel: \text{C}_6\text{H}_{12}\text{O}_6
0.0.1.2.2.1 ↑ Bedeutung
Fotosyntheseprodukt:
6\,\text{CO}_2 + 6\,\text{H}_2\text{O} \longrightarrow \text{C}_6\text{H}_{12}\text{O}_6 + 6\,\text{O}_2
6 CO 2 + 6 H 2 O → C 6 H 1 2 O 6 + 6 O 2 Süße Früchte, Honig
Blitzuckerkonzentration: 120 \,\frac{\mathrm{g}}{\mathrm{l}}
1 2 0 g l Energieträger im Körper
0.0.1.2.2.2 ↑ Nachweisreaktionen
Tollens-/Fehlingprobe → positiv
unspezifisch
GOD-Test
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} & & & \text{H} \\ {} & & / & \\ {} - & \text{C} & & \\ {} & & \backslash\!\backslash & \\ {} & & & \underline{\text{O}}| \end{array} }}_{\text{gelb}} \stackrel{\text{Glucoseoxidase}}{\longrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & \overline{\text{O}}| & \\ {} & & /\!/ & & \\ {} - & \text{C} & & & \\ {} & & \backslash{} & & \\ {} & & & \text{O} & \text{H} \end{array} }}_{\text{Gluconsäure, grün}}
H ∕ − C ∖ ∖ O ¯ ∣ ︸ gelb → Glucoseoxidase O ¯ ∣ ∕ ∕ − C ∖ O H ︸ Gluconsure, grn SCHIFFsche Probe [mit farbloser fuchsinschweflige Säure] → negativ [wegen der Ringbildung der Glucose im Sauren]
Erwärmen → positiv
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & & {\ } & & & & & & & \\ {} & & & | & & & & & & & \\ {} \text{H} & \text{O} & - & \text{C}_1 & - & - & - & - & - & {+} & \\ {} & & & | & & & & & & | & \\ {} & & - & \text{C}_2 & - & \text{O} & \text{H} & & & | & \\ {} & & & | & & & & & & | & \\ {} \text{H} & \text{O} & - & \text{C}_3 & - & & & & | & \text{O} & | \\ {} & & & | & & & & & & | & \\ {} & & - & \text{C}_4 & - & \text{O} & \text{H} & & & | & \\ {} & & & | & & & & & & | & \\ {} & & - & \text{C}_5 & - & - & - & - & - & {+} & \\ {} & & & | & & & & & & & \\ {} & & - & \text{C}_6 & - & \text{O} & \text{H} & & & & \\ {} & & & | & & & & & & & \end{array} } \rightleftharpoons { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & \text{H} & & & & \overline{\text{O}}| & \\ {} & & \backslash{} & & /\!/ & & \\ {} & & & \text{C}_1 & & & \\ {} & & & | & & & \\ {} & & - & \text{C}_2 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C}_3 & - & & \\ {} & & & | & & & \\ {} & & - & \text{C}_4 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C}_5 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C}_6 & - & \text{O} & \text{H} \\ {} & & & | & & & \end{array} }
Zwischen der Aldehydgruppe am \text{C}_1
0.0.1.3 ↑ Haworth-Projektion
{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccccc} {} & & & \text{C}_6 & \text{H}_2 & \text{O} & \text{H} & & & \\ {} & & & | & & & & & & \\ {} & & - & \text{C}_5 & - & \text{O} & \text{H} & & & \overline{\text{O}}| \\ {} & & / & & & & & & /\!/ & \\ {} - & \text{C}_4 & & & & & & \text{C}_1 & & \\ {} & & \backslash{} & | & & | & / & & \backslash{} & \\ {} & & & \text{C}_3 & - & \text{C}_2 & & & & \text{H} \\ {} & & & | & & | & & & & \end{array} } \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} \text{H} & \text{O} & \text{H}_2 & \text{C}_6 & & & & & & & & & \\ {} & & & & \backslash{} & & & & & & & & \\ {} & & & & - & \text{C}_5 & - & \text{\textbf{O}} & & & & \text{\textbf{O}} & \text{\textbf{H}} \\ {} & & & & / & & & & \backslash{} & & / & & \\ {} & & - & \text{C}_4 & & & & & & \text{\textbf{C}}_1 & & & \\ {} & & & & \backslash{} & | & & | & / & & \backslash{} & & \\ {} & & & & & \text{C}_3 & - & \text{C}_2 & & & & \text{H} & \\ {} & & & & & | & & | & & & & & \end{array} }
[Fett: Halbacetel; die fehlenden Bindungspartner an den Strichen ohne eingezeichneten Bindungspartner sind bei dieser Zeichnung nicht notwendigerweise H-Atome, sondern können auch OH-Gruppen sein.]
[Das O vom C₁ greift das H vom C₅ an. Dann ist das C₁ positiv und das O vom C₅ negativ geladen. Schließlich kommt es dann zum Angriff des Os zum C.]
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & \text{H} & \text{O} & \text{H}_2 & \text{C} & & & & & & & & & & \\ {} & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & \\ {} & & & & & \diagup & & \backslash{} & & & & \diagdown & & & & & \\ {} & & \backslash{} & & \diagup & & & & & & & & \diagdown & & / & & \\ {} & & & \text{C} & & & & & & & & & & \text{C}^* & & & \\ {} & & / & & \diagdown & & \text{O} & \text{H} & & & & & \diagup & & \backslash{} & & \\ {} \text{H} & \text{O} & & & & \diagdown & | & & & & | & \diagup & & & & \text{\textbf{O}} & \text{\textbf{H}} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & \end{array} } \longleftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & \text{H} & \text{O} & \text{H}_2 & \text{C} & & & & & & & & & & \\ {} & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & \\ {} & & & & & \diagup & & \backslash{} & & & & \diagdown & & & & \text{\textbf{O}} & \text{\textbf{H}} \\ {} & & \backslash{} & & \diagup & & & & & & & & \diagdown & & / & & \\ {} & & & \text{C} & & & & & & & & & & \text{C}^* & & & \\ {} & & / & & \diagdown & & \text{O} & \text{H} & & & & & \diagup & & \backslash{} & & \\ {} \text{H} & \text{O} & & & & \diagdown & | & & & & | & \diagup & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & \end{array} }
[Die fettgedruckten OHs sind] glykosidische OH-Gruppe[n.]
[Das asymmetrische C-Atom, was über "\alpha
Mutarotation: In wässriger Lösung stellt sich zwischen den anomeren Formen (\alpha_{\alpha\text{-D-(+)-Glucose}} = 112^\circ
Galactose:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & \text{H} & & & & \overline{\text{O}}| & \\ {} & & \backslash{} & & /\!/ & & \\ {} & & & \text{C} & & & \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C} & - & & \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C} & - & & \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \end{array} } \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & \\ {} & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & \\ {} & & \text{H} & \text{O} & & \diagup & | & & & & & \diagdown & & \text{O} & \text{H} & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & \\ {} & & & & & \diagdown & | & & & & | & \diagup & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & \end{array} }}_{\beta\text{-(D)-Galactose}}
H O ¯ ∣ ∖ ∕ ∕ C ∣ − C − O H ∣ H O − C − ∣ H O − C − ∣ − C − O H ∣ − C − O H ∣ → C H 2 O H ∣ C − − − O H O / ∣ \ O H ∣ / \ ∣ C C ∣ \ O H / ∣ \ ∣ ∣ / C − − − C ∣ ∣ O H ︸ β -(D)-Galactose Ringformen:
Pyranose (6-Ring):
Furanose (5-Ring):
L-Mannose:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & \text{H} & & & & \overline{\text{O}}| & \\ {} & & \backslash{} & & /\!/ & & \\ {} & & & \text{C} & & & \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C} & - & & \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C} & - & & \\ {} & & & | & & & \\ {} & & - & \text{C} & - & \text{O} & \text{H} \\ {} & & & | & & & \end{array} } \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & \\ {} & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & \\ {} & & \text{H} & \text{O} & & \diagup & | & & & & & \diagdown & & & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & \\ {} & & & | & \diagdown & & & & & & & & \diagup & | & & & \\ {} & & & & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} & & \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & \text{O} & \text{H} & & & \text{O} & \text{H} & & & & & \end{array} }}_{\alpha\text{-(L)-Mannose}}
H O ¯ ∣ ∖ ∕ ∕ C ∣ − C − O H ∣ − C − O H ∣ H O − C − ∣ H O − C − ∣ − C − O H ∣ → C H 2 O H ∣ C − − − O H O / ∣ \ ∣ / \ ∣ C C ∣ \ / ∣ \ ∣ ∣ / O H C − − − C ∣ ∣ O H O H ︸ α -(L)-Mannose
0.0.1.3.3 ↑ Fructose (Fruchtzucker)
Summenformel: \text{C}_6\text{H}_{12}\text{O}_6
- a)
Vorkommen: Früchte, Pollen, Honig
- b)
Struktur: Ketohexaose
Halbacetalbildung:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & | & & & \\ {} & & - & \text{C}_1 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & & \text{C}_2 & = & \text{O}^\backslash_/ & \\ {} & & & | & & & \\ {} \text{H} & \text{O} & - & \text{C}_3 & - & & \\ {} & & & | & & & \\ {} & & - & \text{C}_4 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C}_5 & - & \text{O} & \text{H} \\ {} & & & | & & & \\ {} & & - & \text{C}_6 & - & \text{O} & \text{H} \\ {} & & & | & & & \end{array} } \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C}_6 & - & - & - & \text{O} & & & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & \text{O} & \text{H} & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C}_5 & & & & & & & & & & \text{C}_2 & & & \\ {} & & & | & \diagdown & & & & & \text{H} & \text{O} & & \diagup & | & & & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & \text{C}_1 & \text{H}_2 & \text{O} & \text{H} \\ {} & & & & & & \text{C}_4 & - & - & - & \text{C}_3 & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & \text{O} & \text{H} & & & & & & & & & \end{array} }}_{\text{Pyranoseform}} \text{ oder } \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & & & & & & \text{O} & & & & & & & & \\ {} & & & & & & \diagup & & & & \diagdown & & & & & & \\ {} \text{H} & \text{O} & \text{H}_2 & \text{C}_6 & & \diagup & & & & & & \diagdown & & \text{C} & \text{H}_2 & \text{O} & \text{H} \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C}_5 & & & & & & & & & & \text{C}_2 & & & \\ {} & & & | & \diagdown & & & & & \text{H} & \text{O} & & \diagup & | & & & \\ {} & & & & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} & & \\ {} & & & & & & \text{C}_4 & - & - & - & \text{C}_3 & & & & & & \\ {} & & & & & & | & & & & | & & & & & & \\ {} & & & & & & \text{O} & \text{H} & & & & & & & & & \end{array} }}_{\text{Furanoseform, }\alpha\text{-D-(-)-Fructose}}
∣ − C 1 − O H ∣ C 2 = O ∕ ∖ ∣ H O − C 3 − ∣ − C 4 − O H ∣ − C 5 − O H ∣ − C 6 − O H ∣ → ∣ C 6 − − − O / ∣ \ O H ∣ / \ ∣ C 5 C 2 ∣ \ H O / ∣ H O \ ∣ ∣ / C 1 H 2 O H C 4 − − − C 3 ∣ ∣ O H ︸ Pyranoseform oder O / \ H O H 2 C 6 / \ C H 2 O H ∣ / \ ∣ C 5 C 2 ∣ \ H O / ∣ \ ∣ ∣ / O H C 4 − − − C 3 ∣ ∣ O H ︸ Furanoseform, α -D-(-)-Fructose [Ringschluss entweder zwischen dem 2. und 6. C-Atom (→ Pyranoseform) oder dem 2. und 5. C-Atom (→ Furanoseform)]
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & & \text{H} & & & \\ {} & & | & & & \\ {} \text{H} & - & \text{C} & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} & & \text{C} & = & \text{O}_/^\backslash & \\ {} & & | & & & \\ {} & & \text{R} & & & \end{array} }}_{\text{Fructose}} \rightleftharpoons \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} \text{H} & & & \\ {} | & & & \\ {} \text{C} & - & \text{O} & \text{H} \\ {} \vert\vert{} & & & \\ {} \text{C} & - & \text{O} & \text{H} \\ {} | & & & \\ {} \text{R} & & & \end{array} }}_{\text{Endiol}} \rightleftharpoons \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{H} & & & & \overline{\text{O}}| & \\ {} & \backslash{} & & /\!/ & & \\ {} & & \text{C} & & & \\ {} & & | & & & \\ {} & - & \text{C} & - & \text{O} & \text{H} \\ {} & & | & & & \\ {} & & \text{R} & & & \end{array} }}_{\text{Glucose}}
→ Fehlingprobe positiv
→ Keto-Enol-Tautomerie [läuft im Alkalischen ab (damit die Fructose nicht in Ringform vorliegt)]
[Spezifischer] Nachweis [der Fructose]: Seliwanow-Reaktion: Fructose, verdünnte Salzsäure, Resorcin (1,3-Dihydroxybenzol) \stackrel{\text{erhitzen}}{\longrightarrow}
Beobachtung: Rotfärbung
Erklärung: Es bildet sich ein roter Farbstoff.
[Die] Reaktion dient zur Unterscheidung von Glucose und Fructose.
0.0.1.4 ↑ Disaccharide
0.0.1.4.4 ↑ Maltose (Malzzucker)
Versuch: Untersuchung einer mit Maltose versetzten Maltose-Lösung
Beobachtung: GOD-Test positiv, Seliwanow-Probe negativ
Erklärung: Maltose muss aus zwei Molekülen \alpha
Die gkykosidische Bindung
Als glykosidische Bindung wird die Bildung eines Vollacetals aus einer glykosidischen und einer alkoholischen Hydroxylgruppe unter Abspaltung von Wasser bezeichnet:
Beispiel:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & \\ {} & & & & & & | & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & \text{H} & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{\textbf{H}} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & \\ {} & & & & & & | & & & & | & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & \end{array} }}_{\text{Halbacetal}} + \underbrace{\text{\textbf{HO}}{-}\text{R}}_{\text{Alkanol}} \stackrel{\text{Kondensation}}{\longrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & \\ {} & & & & & & | & & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{\textbf{O}} & & & & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & \text{\textbf{H}} & & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & & \\ {} & & & \text{C} & & & & & & & & & & \text{\textbf{C}} & & & & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & {+} & - & \text{\textbf{O}} & - & \text{\textbf{R}} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & \\ {} & & & & & & | & & & & | & & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & & \end{array} }}_{\text{Vollacetal}} + \text{H}_2\text{O}
Erfolgt diese Art der Bindung zwischen zwei Monosaccharid-Molekülen, entsteht ein Disaccharid:
Allgemein: 2\,\text{C}_6\text{H}_{12}\text{O}_6 \stackrel{\text{Kondensation}}{\longrightarrow} \text{H}_2\text{O} + \text{C}_{12}\text{H}_{22}\text{O}_{11}
Glykosidische Bindung im Maltose-Molekül
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & \\ {} & & & & & & | & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & \\ {} & & & & & & | & & & & | & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & \end{array} }}_{\alpha\text{-Glucose}} + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & \\ {} & & & & & & | & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & \\ {} & & & & & & | & & & & | & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & \end{array} }}_{\alpha\text{-Glucose}} \stackrel{-\text{H}_2\text{O}}{\longrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & \\ {} & & & & & & | & & & & & & & & & & & & & & | & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & & & & & \text{C} & - & - & - & \text{O} & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & & & & & & & \diagup & | & & & & & \diagdown & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & & | & \diagup & & & & & & & & \diagdown & | & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & \text{C} & & & & & & & & & & \text{C} & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & {+} & - & \text{O} & - & {+} & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & & & & \text{C} & - & - & - & \text{C} & & & & \\ {} & & & & & & | & & & & | & & & & & & & & & & | & & & & | & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & & & & & & & & & \text{O} & \text{H} & & & \end{array} }}_{\text{Maltose: }\alpha\text{-1,4-glykosidische Verknüpfung}}
Bei der Maltose handelt es sich um ein reduzierenden Zucker.
[Im Alkalischen können die Ringe (genauer: mindestens ein Ring) aufgehen und damit die Aldehydgruppe freigeben → Fehlingprobe positiv]
0.0.1.4.5 ↑ Trehalose
[\alpha
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & & & & & & & & \text{O} & \text{H} & & & \\ {} & & & & & & | & & & & & & & & & & & & & & | & & & & | & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & & & & & \text{C} & - & - & - & \text{C} & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & & & & & & & \diagup & | & & & & | & \diagdown & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} & & & & & \diagdown & | & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & \text{C} & & & & & & & & & & \text{C} & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & & | & \diagdown & & & \text{H} & \text{O} & \text{H}_2 & \text{C} & & \diagup & | & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & {+} & - & \text{O} & - & {+} & & \diagdown & & & & & | & \diagup & & \text{O} & \text{H} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & & & & \text{O} & - & - & - & \text{C} & & & & \\ {} & & & & & & | & & & & | & & & & & & & & & & & & & & | & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & & & & & & & & & & & & & \end{array}
0.0.1.4.6 ↑ Saccharose (Rohrzucker)
- a)
Vorkommen: Zuckerrübe/Zuckerrohr
- b)
Aufbau:
[Fehlingprobe positiv, Fehlingprobe, GOD-Test und Saliwanow-Test der Zerlegung in Monosaccharidbausteine durch Salzsäure ebenfalls positiv.]
Erklärung: Saccharose enthält ein Moklekül Glucose und ein Molekül Fructose. \alpha
α β \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & & & & & & & & & & & & & & \\ {} & & & & & & | & & & & & & & & & & & & & & & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & & & & & {+} & - & \text{O} & - & {+} & & & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & & \text{H} & \text{O} & \text{H}_2 & \text{C} & & \diagup & & & & & & \diagdown & & & & & \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & \text{C} & & & & & & & & & & \text{C} & & & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & & | & \diagdown & & & & & \text{H} & \text{O} & & \diagup & | & & & \\ {} & & \text{H} & \text{O} & & \diagdown & | & & & & | & \diagup & & {+} & - & \text{O} & - & {+} & & \diagdown & | & & & & | & \diagup & & \text{C} & \text{H}_2 & \text{O} & \text{H} \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & & & & & | & & & & | & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & & & & & \text{O} & \text{H} & & & & & & & & & \end{array}
C H 2 O H ∣ C − − − O + − O − + / ∣ \ H O H 2 C / \ ∣ / \ ∣ ∣ / \ ∣ C C C C ∣ \ O H / ∣ ∣ \ H O / ∣ H O \ ∣ ∣ / + − O − + \ ∣ ∣ / C H 2 O H C − − − C C − − − C ∣ ∣ ∣ ∣ O H O H Die Saccharose ist ein nicht reduzierender Zucker.
- c)
Inversion der Saccharose
\underbrace{\text{C}_{12}\text{H}_{22}\text{O}_{11}}_{\scriptsize\begin{array}{@{}c}\text{(+)-Saccharose}\\\alpha = 66^\circ\end{array}} \stackrel{\text{H}_3\text{O}^+}{\longrightarrow} \underbrace{\underbrace{\text{C}_6\text{H}_{12}\text{O}_6}_{\scriptsize\begin{array}{@{}c}\alpha\text{-(+)-Glucose}\\\alpha = 56^\circ\end{array}} + \underbrace{\text{C}_6\text{H}_{12}\text{O}_6}_{\scriptsize\begin{array}{@{}c}\beta\text{-(-)-Fructose}\\\alpha = -92^\circ\end{array}}}_{\alpha = 36^\circ}
C 1 2 H 2 2 O 1 1 ︸ (+)-Saccharose α = 6 6 ∘ → H 3 O + C 6 H 1 2 O 6 ︸ α -(+)-Glucose α = 5 6 ∘ + C 6 H 1 2 O 6 ︸ β -(-)-Fructose α = − 9 2 ∘ ︸ α = 3 6 ∘
0.0.1.4.7 ↑ Einteilung der Disaccharide
| Reduzierend | Nicht reduzierend |
|---|---|
| Maltose | Trehalose |
| Lactose (\beta | Saccharose |
| Cellobiose (\beta |
0.0.1.4.8 ↑ Spaltung der glykosidischen Bindung
Die glykosidische Bindung kann durch Enzyme oder Einwirkung von Säuren gespaltet werden.
0.0.1.5 ↑ Polysaccharide
0.0.1.5.9 ↑ Cellulose
- a)
Eigenschaften:
Nachweis: Blaufärbung mit Zinkchloridiodlösung
Unlöslich in Wasser
- b)
Struktur:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccccccccccccccccccccccccccccccc} {} & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & & & & & & & & \text{O} & \text{H} & & & & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & \\ {} & & & & & & | & & & & & & & & & & & & & & | & & & & | & & & & & & & & & & | & & & & & & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{O} & & & & & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & & & & \text{C} & - & - & - & \text{O} & & & & & & \\ {} & & & & & \diagup & | & & & & & \diagdown & & {+} & - & \text{O} & - & {+} & & \diagup & | & & & & | & \diagdown & & & & & & & & \diagup & | & & & & & \diagdown & & {+} & - & \text{O} & - \\ {} & & & | & \diagup & & & & & & & & \diagdown & | & & & & | & \diagup & & \text{O} & \text{H} & & & & & \diagdown & | & & & & | & \diagup & & & & & & & & \diagdown & | & & & \\ {} & & & \text{C} & & & & & & & & & & \text{C} & & & & \text{C} & & & & & & & & & & \text{C} & & & & \text{C} & & & & & & & & & & \text{C} & & & \\ {} & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & & | & \diagdown & & & & & & & & \diagup & | & & & & | & \diagdown & & \text{O} & \text{H} & & & & & \diagup & | & & & \\ {} - & \text{O} & - & {+} & & \diagdown & | & & & & | & \diagup & & & & & & & & \diagdown & & & & & & \diagup & & {+} & - & \text{O} & - & {+} & & \diagdown & | & & & & | & \diagup & & & & & \\ {} & & & & & & \text{C} & - & - & - & \text{C} & & & & & & & & & & \text{C} & - & - & - & \text{O} & & & & & & & & & & \text{C} & - & - & - & \text{C} & & & & & & \\ {} & & & & & & | & & & & | & & & & & & & & & & | & & & & & & & & & & & & & & | & & & & | & & & & & & \\ {} & & & & & & & & & & \text{O} & \text{H} & & & & & & & & & \text{C} & \text{H}_2 & \text{O} & \text{H} & & & & & & & & & & & & & & & \text{O} & \text{H} & & & & & \end{array}
C H 2 O H O H C H 2 O H ∣ ∣ ∣ ∣ C − − − O C − − − C C − − − O / ∣ \ + − O − + / ∣ ∣ \ / ∣ \ + − O − ∣ / \ ∣ ∣ / O H \ ∣ ∣ / \ ∣ C C C C C C ∣ \ O H / ∣ ∣ \ / ∣ ∣ \ O H / ∣ − O − + \ ∣ ∣ / \ / + − O − + \ ∣ ∣ / C − − − C C − − − O C − − − C ∣ ∣ ∣ ∣ ∣ O H C H 2 O H O H Bausteine:
Monosaccharid: \beta
β Disaccharid: Cellobiose (\beta
β
Lineare Ketten (6000-18000 Glucose-Moleküle)
- c)
Vorkommen:
Zellwand von Pflanzenzellen
Holz
Baumwolle, Sisal, Jute, Hanf
[Wir haben kein Enzym, um Cellulose zerlegen zu können.]
- d)
Bedeutung der Cellulose:
Nährstoffquelle: Hauptnahrungsquelle der Wiederkäuer; Abbau erfolgt im Pansen durch Cellulase produzierende Darmbakterien
→ Sicherung der Fleichversorgung
Faserrohstoff: Rohstoff für Textil- und Faserindustrie
Naturfasern aus Baumwolle, Hanf, Sisal, Jute
Rohstoff für halbsynthetische Fasern, z.B. Viskose
→ Die Cellulosefasern werden dabei verändert, es entstehen Stoffe mit speziellen Eigenschaften (Festigkeit, Wasserbeständigkeit).
Papierindustrie: Cellulose = Zellstoff
Jährlicher Papierverbrauch pro Kopf in Deutschland 2001: 225 kg
Papierherstellung: Frischfaser oder Recyclingpapier
Geringerer Energie- und Wasserverbrauch bei Herstellung von Recyclingpapier
0.0.1.5.10 ↑ Stärke
- a)
Vorkommen: Mehl, Kartoffel
- b)
Nachweis: Iod-Kaliumiodidlösung → [Färbung:] blauviolett
Einlagerungsverbindung
XXX Grafik
- c)
Struktur: Zwei Bestandteile:
Amylose (20 %)
XXX Grafik
250–300 [\alpha
α Amylopektin (80 %)
XXX Grafik; zusätzliche 1,6-Verzweigung
22.000 Bausteine; verzweigt
Glykogen ist der entsprechende tierische Reservestoff.